Новости рынка
СОКовыжималка: материалы по вашим интересам
СОК Профи: обзоры для специалистов
Научные статьи
- Эксплуатация в холодную погоду градирен, связанных с системами холодоснабжения с водяным охлаждением конденсатора Данная статья рассматривает особенности работы в холодную погоду градирен открытого типа, связанных с системами холодоснабжения с водяным
- Состав сточных вод от автоматических натрий-катионитовых фильтров В процессе проектирования технологической схемы химической водоподготовки (ХВО) с использованием автоматического фильтра умягчения методом Na-катионирования в пояснительной записке
- Ещё раз о сифонах… и не только Санитарно-техническая водосливная арматура — это сифоны, выпуски, переливы, трапы и т.д. Какие технические требования к сифонам существуют? Почему они такие, и чем это обусловлено? Насколько эти требования актуальны и корректны на
- Экопереработка отходов и возобновляемые источники энергии в агропромышленных кластерах В современных реалиях, в условиях перенаселённости городов многие городские жители задумываются о переезде в сельскую местность. К сожалению,
- Технология вторичного использования ветроэнергетических установок с технико-экономической целесообразностью В статье представлен анализ процесса демонтажа современных ветроэнергетических установок (ВЭУ). Обзор составлен на базе действующих инструкций
- Применение материала RC в современном производстве трубопроводов В статье изучается производство полиэтиленовых трубопроводов из инновационного материала ПЭ-100RC.
- Выставка «Тепло и Энергетика» — крупнейшая бизнес-площадка профессионалов малой и большой энергетики Международная выставка оборудования для теплоснабжения и электрогенерации промышленных
- Разговор о доме, который заработает вам деньги, или Завтрашние инновации сегодня В первый день деловой программы выставки Aquaflame 20254 февраля 2025 года (13:15–15:15) в МВЦ «Крокус Экспо» (павильон 3, зал 15, конференц-зал B) пройдет важнейшая дискуссия «Энергоактивное и пассивное
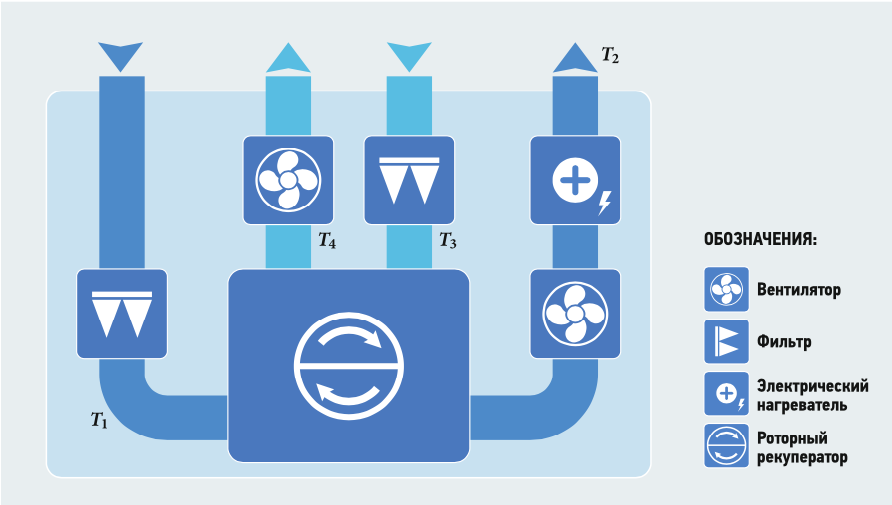
- Анализ перспектив применения расходомеров в компактных приточно-вытяжных установок с роторным рекуператором Система теплоснабжения здания офисного или торгово-развлекательного назначения имеет подсистемы: горячего водоснабжения, отопления
- Тепловая мощность потребителей при различных воздухообменах в учебных кабинетах школы Проведена оценка влияния величины расчётного воздухообмена в учебных кабинетах на тепловую мощность воздухонагревателей приточных установок