Рис. 1. Диаграммы равновесия «жидкость–пар» для идеальных смесей
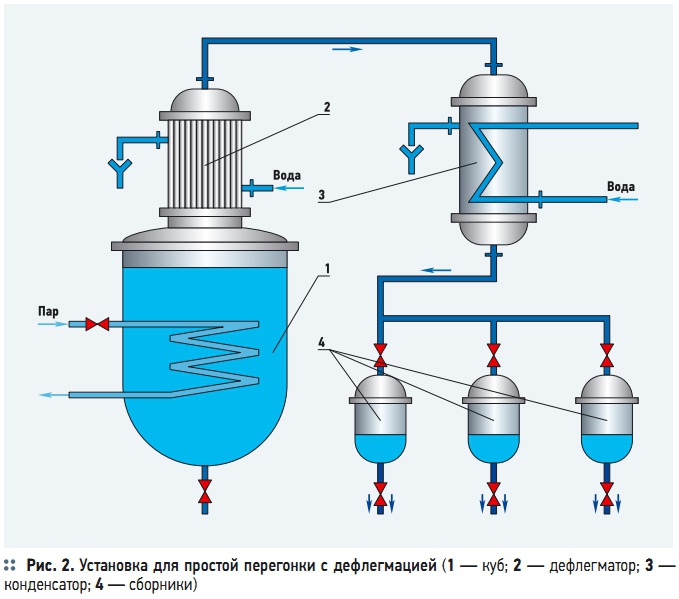
Рис. 2. Установка для простой перегонки с дефлегмацией
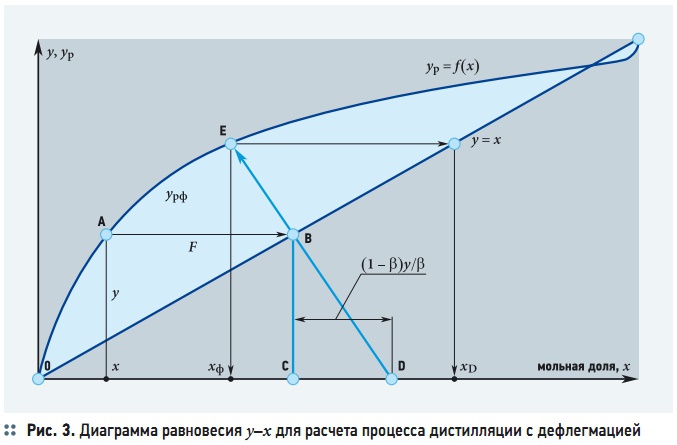
Рис. 3. Диаграмма равновесия у–х для расчета процесса дистилляции с дефлегмацией
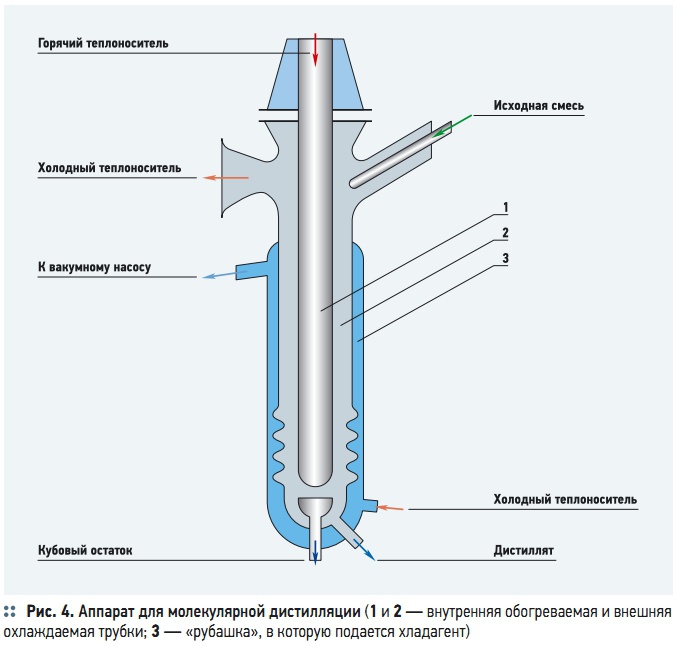
Рис. 4. Аппарат для молекулярной дистилляции
Подпись
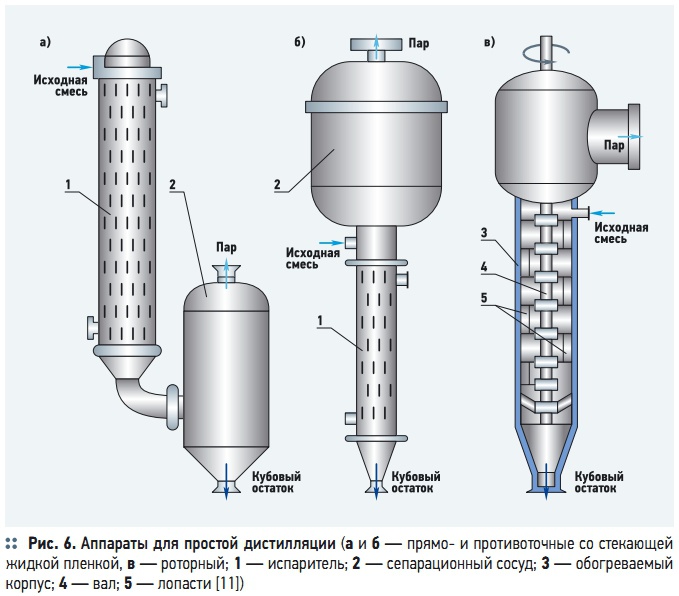
Рис. 6. Аппараты для простой дистилляции
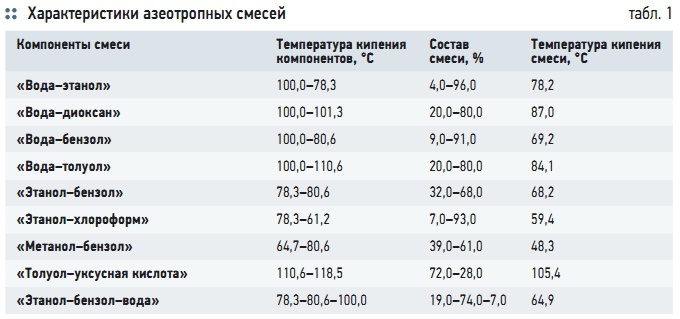
Табл. 1. Характеристики азеотропных смесей
Дистилляция — это наиболее распространенный метод разделения жидких однородных смесей, состоящих из двух или нескольких летучих компонентов за счет частичного испарения жидкости и образования пара, при конденсации которого образуется дистиллят, содержащий больше легколетучего компонента, чем исходная жидкость.
Дистилляцию повсеместно применяют в химической, нефтеперерабатывающей, фармакологической, пищевой промышленности, в лабораторной практике для разделения жидких смесей, представляющих собой легколетучий компонент с некоторым содержанием труднолетучих компонентов, очистки веществ от различных примесей — масел, жиров и других загрязнений, а также при получении технического и пищевого этилового спирта, в производстве ароматических веществ, эфирных масел и др.
Дистилляция. Общие положения
Дистилляция (перегонка) базируется на различии в составе жидкости и образующегося из нее пара, а также на различиях температур кипения, парциальных давлений и коэффициентов летучести (распределения компонента в жидкости и паре) отдельных компонентов, входящих в состав разделяемой жидкой смеси [1]. В результате испарения жидкости над ней устанавливается определенное давление пара и равновесие между паром и жидкостью. При повышении температуры упругость пара над жидкостью возрастает, и когда давление пара становится равным внешнему давлению, происходит кипение жидкости.
Процесс дистилляции осуществляется в дистилляционных установках путем частичного испарения кипящей жидкости и последующей конденсации пара [2]. В процессе дистилляции более летучий компонент (низкокипящий) переходит в паровую фазу в большем количестве, чем менее летучий (высококипящий). Поэтому при конденсации образовавшихся паров в конденсат (дистиллят) переходят низкокипящие, а в оставшийся кубовый остаток выделяются оставшиеся труднолетучие (высококипящие) компоненты.
Дистиллят образуется при конденсации паров в конденсаторе-дефлегматоре, а кубовый остаток — в перегонном кубе установки. Если из исходной жидкой смеси отгоняется не одна фракция, а несколько, дистилляция называется фракционной (дробной).
В зависимости от условий проведения различают простую перегонку, фракционную дистилляцию, ректификацию и молекулярную дистилляцию [3].
Простая перегонка — частичное испарение жидкой смеси за счет непрерывного отвода и конденсации образовавшихся паров (дистиллят) в холодильнике. Чаще всего используется при перегонке воды и водных смесей. Простую перегонку можно проводить при атмосферном давлении или под вакуумом (для снижения температуры кипения). Для получения нужных фракций (или разного состава дистиллята) применяют фракционную или дробную дистилляцию.
Фракционная дистилляция (или дробная перегонка) — разделение многокомпонентных жидких смесей на отличающиеся по составу части — фракции путем сбора конденсата частями с различной летучестью, начиная с первой, обогащенной низкокипящим компонентом. При этом жидкий остаток обогащается высококипящим компонентом. Для улучшения разделения фракций применяют дефлегматор, где происходит частичная конденсация паров из перегонного аппарата (куба).
Ректификация — это способ дистилляции, при котором часть жидкого конденсата (флегма) постоянно возвращается в куб, подвергаясь многократному испарению, и двигаются навстречу пару в контакте с ним. В результате этого примеси, содержащиеся в паре, частично переходят во флегму и возвращаются в куб, в результате степень очистки пара (и конденсата) повышается.
Молекулярная дистилляция основана на зависимости скорости испарения вещества от его молекулярной массы при температурах ниже температуры кипения жидкости и низких давлениях (< 0,13 Па). При таких давлениях длина свободного пробега молекул соизмерима с расстоянием между поверхностями испарения жидкости и конденсации пара. В этом процессе молекулы разделяемого компонента сталкиваются между собой относительно редко и движутся практически независимо друг от друга, а расход и состав паровой смеси определяется скоростями испарения отдельных компонентов.
Расчет процессов дистилляции
Простая перегонка проводится при давлениях, когда длина свободного пробега молекул во много раз меньше, чем расстояние между поверхностями испарения жидкости и конденсации пара. Температура процесса при заданном давлении определяется условиями фазового равновесия между жидкостью и образующимся из нее паром. Простая однократная перегонка применяется в тех случаях, когда температуры кипения разделяемых компонентов отличаются более чем на 80 °C. Простую перегонку целесообразно применять для жидкостей с температурой кипения от 40 до 150 °C, так как выше 150 °C многие соединения начинают разлагаться, а жидкости с температурой кипения до 40 °C нельзя перегнать без значительных потерь в обычных приборах. При необходимости снижения температуры применяют дистилляцию под вакуумом, а также с водяным паром или инертным газом.
В теоретических расчетах процесса дистилляции чаще всего рассматриваются двухкомпонентные (бинарные) смеси. Действие дистилляции основано на том, что концентрация некоторого компонента в жидкости (или двух компонентов) отличается от его концентрации в образующемся из жидкости паре.
Распределение компонентов смеси между жидкостью и паром характеризуется коэффициентом относительной летучести (или же распределения):

где хi и xk, уi и yk — содержания компонентов i и k в жидкости и образующемся из нее паре, соответственно.
Состав образующегося из жидкости пара определяется физико-химическими свойствами и межмолекулярным взаимодействием компонентов. При небольших давлениях, когда свойства пара в равновесном состоянии подчиняется законам идеальных газов (то есть предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией), между молекулами не действуют силы притяжения или отталкивания, соударения молекул между собой абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями. В этих условиях коэффициент летучести рассчитывается как:

где pi0 и pk0 — давления паров чистых компонентов i и k при температуре кипения жидкой смеси; γi и γk — коэффициенты активности этих компонентов в жидкой фазе.
Коэффициенты активности имеют температурную и концентрационную зависимости. С понижением температуры значение коэффициента разделения обычно удаляется от единицы, то есть эффективность разделения увеличивается. В математических расчетах также используют обратное значение коэффициента разделения α = 1/β. Коэффициент разделения зависит от природы разделяемых компонентов, межмолекулярных взаимодействий и режима дистилляции. В зависимости от условий дистилляции, различают идеальный (определяемый только парциальными давлениями пара чистых компонентов), равновесный (когда число молекул, покидающих в единицу времени жидкость, равно числу молекул, возвращающихся в это же время в жидкость) и эффективный коэффициенты разделения [4].
Дистилляция зависит от интенсивности перемешивания жидкости, а также от взаимодействия компонентов с основным компонентом и с другими компонентами с образованием химических соединений. Поэтому на практике эффективный коэффициент разделения жидких смесей может на несколько порядков отличаться от идеального коэффициента разделения.

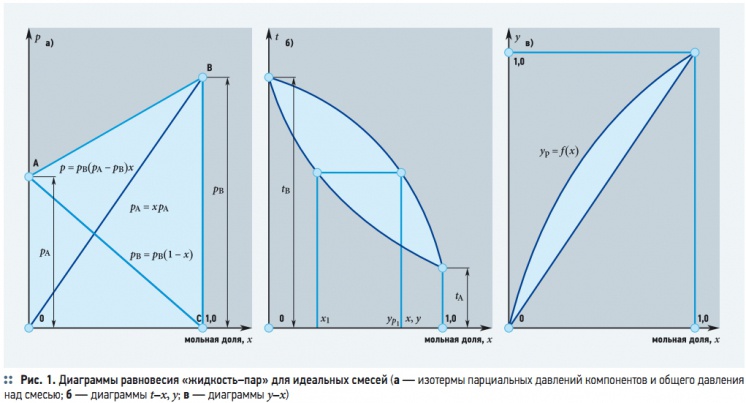
Расчет процесса дистилляции производится графоаналитическим способом по диаграммам равновесия «жидкость– пар» для идеальных смесей (рис. 1a–в). Прямые ОВ и СА на рис. 1а показывают изменение парциальных давлений компонентов (рА и рВ), прямая АВ — изменение общего давления над исходным раствором. Вертикальные отрезки ОА и СВ определяют давление насыщенных паров чистых компонентов (рВ и рА).
Согласно закону Дальтона парциальное давление компонента в паре пропорционально мольной доле этого компонента в паре:
рА = рy; рВ = р(1 – y), (3)
где р — общее давление в системе; у и (1 – у) — мольные доли компонента А и компонента В в паровой смеси. Для условия равновесия имеем:
рАх = ру; рB(1 – х) = р(1 – у), (4)
откуда:

Обычно процессы перегонки проводят в изобарических условиях, поэтому расчет идеальной бинарной смеси идет при р = const. В этом случае равновесную зависимость можно представить в координатах t–х, у (рис. 1б) или у–х (рис. 1в). Учитывая температуры и рассчитав величины х и у, строится диаграмма, характеризующая равновесие в системе «жидкость–пар». Нижняя кривая на диаграмме (рис. 1б) определяет температуры кипения жидкой смеси, верхняя — температуры конденсации паровой смеси. Отрезки, отложенные по осям ординат при х = 0 и x = 1,0, определяют температуры кипения труднои легколетучего компонентов.
Для определения состава пара по известному составу жидкости х1 из точки на оси абсцисс, соответствующей концентрации жидкости, проводят вертикальную прямую до пересечения с линией кипения. Далее из точки пересечения проводят горизонтальную прямую до пересечения с линией конденсации пара. Абсцисса точки пересечения этих прямых определяет состав равновесного пара ур1. При одной и той же температуре кипения концентрация легколетучего компонента в парах больше его концентрации в равновесной с парами жидкости, поскольку пар обогащается тем компонентом, добавление которого к жидкости повышает давление пара над этой жидкостью или снижает ее температуру кипения. Для расчетов процессов ректификации используется диаграмма у–х (рис. 1в), построенная на основе диаграммы t–х, у. Функциональная зависимость у = f (x) соответствует уравнению:

которое выражает зависимость между равновесными составами жидкой и паровой фаз. Зная относительную летучесть компонентов α = pA/pB, можно рассчитать и построить кривую равновесия для идеальных смесей:

Режимы дистилляции характеризуются температурой испарения и степенью отклонения от фазового равновесия «жидкость–пар». Обычно в дистилляционном процессе n = n1 + n2, где n — число частиц вещества, переходящих в единицу времени из жидкости в пар; n1 — число частиц, возвращающихся в это же время из пара в жидкость; nc — число частиц, переходящих в это время в конденсат. Отношение nc/n является показателем отклонения процесса от равновесного. Предельными являются режимы, в которых nc = 0 (равновесное состояние системы «жидкость–пар») и nc = n (режим молекулярной дистилляции). В этом режиме коэффициент разделения выражается формулой:

где M1 и M2 — величины молекулярных масс первого и второго компонентов, соответственно.
Определение молекулярного режима дистилляции возможно по величине N = h/(Kλ), где h — расстояние от испарителя до конденсатора; λ — длина свободного пробега молекул разделяемого вещества; K — константа, зависящая от конструкции аппарата. При N < 0,25 наблюдается молекулярное испарение, при N > 4 между жидкостью и паром устанавливается динамическое равновесие, а при других значениях N испарение имеет промежуточный характер.
При составлении материального баланса простой перегонки предполагается, что в некоторый момент времени τ в перегонном кубе находится L [кг] смеси с концентрацией х низкокипящего компонента. За бесконечно малый промежуток времени dτ испаряется dL [кг] жидкости, тогда количество жидкости и ее состав изменяются на величину (L – dL) и (x – dx), соответственно.
Количество образующегося за этот промежуток времени пара равно уменьшению количества жидкости dL, а его состав ур находится в равновесии с низкокипящим компонентом х. Содержание летучего компонента в жидкости в начале рассматриваемого промежутка времени — Lx, а в конце — (Ld – L)(x – dx). Количество летучего компонента, перешедшего за этот промежуток времени в пар, равно урdL.
Таким образом, уравнение материального баланса по летучему компоненту за данный промежуток времени записывается следующим образом:
Lx = (L – dL)(x – dx) + ypdL. (9)
Преобразуя это уравнение и пренебрегая членом dLdx как бесконечно малой величиной второго порядка, получим уравнения:

В начальный момент перегонки количество жидкости в аппарате равно количеству начальной смеси F (состава xF), а в конечный момент — количеству кубового остатка W (состава xW). Таким образом, пределы интегрирования уравнения (10) будут для левой части — F и W, а для правой части — xF и xW:

Интегрируя левую часть, получим уравнение Рэлея, справедливое для однократной загрузки смеси:

Вид функции у = f (x) устанавливается экспериментальным путем, а интегрирование правой части уравнения (12) проводится графически. Для этого для ряда значений х в пределах от xF до xW находят из диаграммы у–х равновесные значения ур (рис. 1в). Затем строят зависимость y от х и по величине площади под кривой, ограниченной значениями xF и xW, определяют величину искомого интеграла. После этого по уравнению (12), зная начальное количество разделяемой смеси F, ее концентрацию xF и концентрацию кубового остатка xW, определяют количество кубового остатка W.
Средний состав дистиллята определяют из следующего уравнения материального баланса:
FxF = WxW + (F – W)xdср , откуда (14)

Для различных режимов дистилляции выведены математические уравнения, связывающие содержание второго компонента в конденсате (дистилляте) C/C0 и в остатке C1/C0 с долей конденсата G/G0 или с долей кубового остатка G1/G0 при заданных условиях процесса и известной начальной концентрации C0 жидкой смеси (G, G1 и G0 — масса конденсата, кубового остатка и исходная масса раствора) [5]. Расчеты проводятся в предположении идеального перемешивания дистиллируемой жидкости.
При дистилляции жидких смесей с большой концентрацией компонентов с конденсацией пара в жидкость при незначительной зависимости коэффициентов активности компонентов от их концентраций, взаимосвязь величин G1/G0, C1 и C0, при использовании концентрации компонентов в [%], имеет вид:

Для дистилляции с конденсацией водяного пара в жидкость при малом содержании компонентов, эти уравнения имеют вид:

где β — отношение концентраций компонентов в паре и в жидкости. Уравнения материального баланса при дистилляции жидких смесей могут использоваться для описания процессов распределения в других системах с фазовыми переходами из фазы с интенсивным перемешиванием (переходы «жидкий кристалл–кристалл», «жидкий кристалл–жидкость», «газ–плазма» и «газ–сверхтекучая жидкость» и др.), с учетом соответствующих коэффициентов разделения [6].
Перегонка с дефлегмацией
Степень разделения компонентов в условиях простой перегонки может быть повышена применением дефлегмации (рис. 2). В этом случае пары, уходящие из перегонного куба 1 поступают в дефлегматор 2, где они частично конденсируются. При частичной конденсации паров образуется флегма, обогащенная труднолетучим компонентом, которая сливается обратно в куб и взаимодействует с выходящими из куба паром, обогащенным легколетучим компонентом. Полученный в дефлегматоре конденсат или флегма возвращается в перегонный куб и подвергается многократному испарению, а чистый дистиллят собирается в сборниках. Кубовый остаток удаляют из перегонного куба после достижения заданной концентрации xW. При дистилляции двухкомпонентной (бинарной) жидкой смеси с дефлегмацией возвращаемая в куб флегма с концентрацией низкокипящего компонента хф находится в равновесии с остаточным паром, имеющим концентрацию урф того же компонента. Если концентрация компонента в паре перед дефлегматором равна у, и из элементарного количества пара dG образуется βdG флегмы, то материальный баланс дефлегматора можно описать следующим уравнением:

В процессе дистилляции величины х, у, хф и урф непрерывно изменяются, поскольку из системы непрерывно отводится дистиллят. Значения хф и урф определяются графическим путем, используя диаграмму равновесия у–х (рис. 3).
Для этого из точки А(х, у), соответствующей мгновенному составу пара на выходе из перегонного куба, проводится горизонтальная прямая линия АВ до пересечения с диагональю диаграммы. Затем опускается перпендикуляр ВС. От точки С по оси абсцисс вправо откладывается отрезок:

а из точки D через точку В проводится наклонная линия до пересечения с кривой равновесия. Ордината точки Е выражает искомую концентрацию урф пара, выходящего из дефлегматора. При этом хD = урф. Вывод уравнения (12) справедлив и для дистилляции с дефлегмацией, с разницей, что во всех уравнениях состав пара, равновесный с составом жидкости х, заменяется на состав пара урф, выходящего из дефлегматора. Таким образом, уравнение (12) для дистилляции с дефлегментацией принимает вид:

Молекулярная дистилляция
Молекулярная дистилляция осуществляется свободным испарением жидкостей в глубоком вакууме при низком давлении пара и при температуре ниже точки кипения, при близком расположении поверхности конденсации к поверхности испарения, что исключает столкновение молекул пара друг с другом и с молекулами атмосферы. Рабочий вакуум находится в диапазоне 10–2 – 10–4 мм рт. ст. (1,30–0,13 Па) и создается с помощью вакуумных насосов [7]. Благодаря вакууму молекулы пара движутся от горячей (испаряющей) поверхности к холодной (конденсирующей) с минимальным числом столкновений, а длина свободного пробега молекул при таких давлениях соизмерима с расстоянием между поверхностями испарения жидкости и конденсации пара. Данный метод применяется для разделения жидкостей, кипящих при высоких температурах и не обладающих необходимой термической стойкостью.
Поскольку коэффициент разделения при молекулярной дистилляции зависит не только от парциальных давлений компонентов, но и от их молекулярных (или атомных) масс, молекулярная дистилляция может применяться для разделения смесей, для которых β = 1, то есть азеотропных смесей двух или более жидкостей, состав которой не меняется при кипении, то есть смесей с равенством составов равновесных жидкой и паровой фаз. Эти компоненты с различными температурами кипения трудно разделяются в чистом виде с помощью перегонки (табл. 1). Существование таких смесей обусловлено взаимодействием молекул в жидкости за счет сил физической и химической природы: сольватации, межмолекулярных сил, диполь-дипольных взаимодействий, водородных связей и др.
Существует более чем 10 000 двойных и многокомпонентных систем, имеющих температуры кипения как более высокие, так и более низкие, чем каждый из компонентов смеси в отдельности (табл. 1).
Например, азеотропная смесь воды и этилового спирта, содержащая 95,57 % C2H5OH, кипит при температуре 78,15 °C. Этим объясняется максимально достижимая степень очистки этилового спирта 96 %, так как дальнейшей простой перегонкой ее нельзя разделить на фракции.
Для определения скорости испарения чистого компонента с молекулярной массой М в расчетах молекулярной дистилляции используют уравнение Кнудсена Ленгмюра:

где р — давление пара вещества при температуре жидкости; М — молекулярная масса компонента; Т — температура. Эта скорость испарения компонента смеси меньше, чем скорость испарения чистого вещества, и пропорциональна его молярной доле в смеси.
Расчет коэффициента распределения производится по формуле:

где хi и xk, уi и yk — содержания компонентов i и k в жидкости и паре; pi0 и pk0 — давления паров чистых компонентов i и k при температуре кипения жидкой смеси; Mi и Mk — молекулярные массы компонентов i и k в жидкости и паре.
Коэффициент распределения при молекулярной дистилляции зависит не только от давлений паров чистых компонентов при заданной температуре, но и от их молекулярной массы. Это позволяет разделять жидкие смеси, используя различие молекулярных масс компонентов при относительно низких температурах. Процесс включает перенос молекул испаряющегося компонента из объема жидкости к поверхности испарения, испарение молекул, перенос их в объеме паровой фазы от поверхности испарения к поверхности конденсации и саму конденсацию. Так как при молекулярной дистилляция кипения жидкости не происходит, перемешивание паровыми пузырями, характерное для обычной дистилляция, отсутствует, и перенос вещества по объему жидкости осуществляется за счет молекулярной диффузии. Поскольку этот процесс более медленный, чем испарение с поверхности, жидкость со стороны поверхности обедняется относительно более летучими компонентами и в ней возникает градиент концентраций, что ухудшает условия разделения смеси. Для предотвращения этого уменьшают толщину слоя жидкости и обеспечивают ее равномерное перемешивание. Скорость испарения молекул с поверхности жидкости определяется ее температурой — чем она выше, тем больше давление пара и скорость испарения. Однако при увеличении давления пара уменьшается длина свободного пробега молекул и возрастает частота их соударений, что приводит к снижению эффективности разделения смеси.
С целью ее повышения дистилляцию проводят при более высоких давлениях, чем те, при которых молекулы достигают поверхности конденсации без соударений. Каждой смеси отвечает оптимальная температура, при которой достигается наибольшая степень разделения. Для оценки последней используют представление о теоретической молекулярной тарелке, под которой понимается устройство, обеспечивающее получение дистиллята с содержанием компонентов, соответствующим соотношению скоростей их испарения при данной температуре, а состав жидкости во всем ее объеме одинаков, то есть жидкость идеально перемешана. В производственных условиях при однократном испарении степень разделения компонентов варьирует от 0,3 до 0,95 теоретической тарелки [8].
Жидкая смесь в аппарате для молекулярной дистилляции (рис. 4) распределяется в виде пленки на наружной поверхности внутренней трубки, которая обогревается подаваемым в нее теплоносителем. На расстоянии 20–30 мм (это расстояние должно быть меньше длины свободного пробега молекул) от этой трубки расположена специальная внешняя трубка, снабженная «рубашкой», в которую подается хладагент. Покидающие поверхность испарения молекулы летучего компонента попадают на поверхность конденсации и конденсируются на ней. Кубовый остаток и дистиллят, полученный на охлаждаемой поверхности, отводятся снизу. Разность температур между поверхностями испарения и конденсации ≈ 100 °C. Для поддержания требуемого остаточного давления рабочее пространство аппарата соединено с вакуумной системой. По способу создания пленки различают аппараты со стекающей жидкостью и центробежные (промышленные — с ротором диаметром до 3 м), позволяющие перерабатывать за 1 ч до 1 т разделяемой смеси.
Классификация и расчет дистилляционных аппаратов
Аппараты, применяемые для дистилляции, подразделяются на емкостные и пленочные [9]. В емкостных аппаратах обрабатывается большой объем жидкой смеси, интенсивно перемешиваемой в результате кипения. Состав образующегося пара близок к равновесному и определяется по уравнению:

где n — число компонентов в водной смеси; хi и xk — содержания компонента i и k в жидкости.
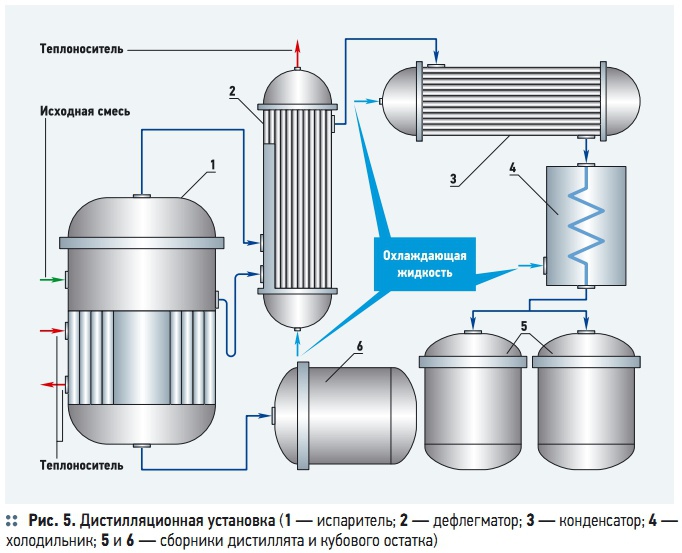
Типовая дистилляционная установка состоит из испарителя 1, снабженного теплообменным устройством для подвода к воде необходимого количества теплоты; дефлегматора 2 для частичной конденсации пара, выходящего из испарителя (при фракционной дистилляции); конденсатора 3 для конденсации отбираемого пара; холодильника 4; сборников дистиллята 5 и кубового остатка 6 (рис. 5). Для повышения эффективности разделения дистилляционные аппараты могут снабжаться двумя или более конденсаторами, работающими при различных температурах, что дает возможность разделять смесь на несколько фракций. Применяют также многоступенчатые противоточные аппараты, коэффициент разделения смеси в которых во много раз больше, чем в одноступенчатых [10].
Дистилляционные аппараты используют как для периодической, так и для непрерывной дистилляции [11]. В первом случае содержание низкокипящих компонентов в паре постепенно убывает, и средний состав дистиллята является промежуточным между составом паров, находящихся в равновесии с жидкой смесью, и кубовым остатком. Во втором случае состав жидкой смеси в аппарате практически идентичен составу кубового остатка, а состав дистиллята — составу равновесного с этой жидкостью пара. Поскольку дистиллят образуется в результате парообразования смеси конечного состава с наименьшим содержанием низкокипящих компонентов, в емкостных аппаратах при непрерывной дистилляции достигается меньшая степень разделения жидкой смеси, чем при периодической дистилляции.
В пленочных аппаратах кипящая жидкость распределяется по поверхности нагрева в виде пленки. По способу ее образования различают: аппараты с жидкостью, свободно стекающей по обогреваемой поверхности, например, по поверхности труб с помощью специальных распределительных устройств (рис. 6а–б), а также с восходящим движением жидкости за счет силы трения на границе между водой и паром, движущимся снизу вверх с достаточно большой скоростью; роторные — с водой, растекающейся по внутренней поверхности обогреваемого корпуса при вращении ротора с неподвижными или подвижными лопастями (рис. 6в).
По характеру движения фаз пленочные аппараты подразделяются на прямои противоточные. Объем и время пребывания жидкостей в пленочных аппаратах очень малы, поэтому они используются только при непрерывной дистилляции и особенно эффективны при перегонке термолабильных компонентов и вязких растворов. Состав жидкости в пленочных аппаратах изменяется по высоте, что обусловливает изменение температуры и состава пара.
Жидкость и пар, между которыми происходит теплои массообмен, проходят через произвольное сечение аппарата, и не находятся в равновесии. Скорость и влияние теплои массообмена на эффективность процесса определяются скоростями и характером движения фаз. Уравнение материального баланса для элемента высоты аппарата dh в этом случае имеет вид:
d(Gyi) = –d(Wxi) = –yipdG + Kоуa(yi – yiр)dh, (25)
где G и W — расходы пара и жидкости; yip — содержание компонента i в паре, находящемся в равновесии с жидкостью состава xi; уi — состав пара, проходящего через сечение аппарата; Коу — коэффициент массопередачи; а — площадь поверхности массообмена на единицу высоты аппарата.
При отводе образующегося пара (теплои массообмен с жидкостью исключены) уравнение (25) преобразуется в уравнение простой дистилляции. Поскольку Коу > 0, знак второго слагаемого в правой части этого уравнения зависит от характера движения фаз.
Расход теплоты Q на проведение дистилляции определяется по уравнению теплового баланса. Если в аппарат первоначально загружено W1 [кмоль] жидкой бинарной смеси с концентрацией низколетучего компонента х1, непрерывно подводится W1 ? [кмоль/с] той же смеси, а отводится W2 [кмоль/с] паров дистиллята (непрерывный процесс), уравнение теплового баланса принимает вид:
Q + (W1 + W1 ?r) ix ? = = W2ix ? + (W1 + W1r – W2) iд, (26)
где W1 — количество исходной бинарной смеси, кмоль; х1 — концентрация низкокипящего компонента в смеси, кмоль; W2 — количество паров дистиллята, кмоль; ix? и ix? — энтальпии исходной жидкой смеси и кубового остатка; iд — энтальпия паров дистиллята.
В случае W1? = 0 (периодический процесс) получим:
Q + W1i x? = W2ix? + (W1 – W2)iд. (27)
Площадь поверхности нагрева испарителя находится из уравнения теплопередачи с учетом изменения коэффициента теплопередачи и разности температур теплоносителя и кипящей жидкости с изменением ее состава во времени (при периодической дистилляции) или по высоте (при непрерывной дистилляции) [12]. При определении величины поверхности нагрева аппарата дистилляции периодического действия F следует учитывать, что процесс протекает в условиях нестационарного конвективного теплообмена, то есть при непрерывном росте температуры кипения жидкости tx и падении коэффициента теплопередачи К. Если перегонный куб обогревается конденсирующимся паром с температурой насыщения tнас, то поверхность нагрева F и продолжительность процесса τ связаны следующим дифференциальным уравнением:
dQ = KF(tнас – tx)dτ. (28)
Поскольку зависимости К и tx от Q являются весьма сложными, то расчет по уравнению (28) проводится графоаналитическим методом.
При дистилляции с дефлегмацией (конденсация преимущественно высококипящих компонентов при охлаждении смесей с целью их обогащения низкокипящими компонентами) зависимость состава пара уi , поступающего из испарителя в дефлегматор, с составами возвращаемой жидкости (флегмы) хiф и пара yiф, направляемого в конденсатор, определяется конструкцией и режимом работы дефлегматора. Обычно принимают, что выходящие из него жидкость и пар находятся в равновесном состоянии. Тогда взаимосвязь xiф и yiф описывается уравнением (24), а количества и состава жидкости в аппарате — уравнением (13), в которое вместо уp подставляют уiф. Бо ´льшая, чем при простой дистилляции, степень разделения смеси достигается благодаря частичной конденсации пара, образующегося в испарителе, и соответствующего увеличения расхода теплоты.
Для отгонки из смесей высококипящих компонентов с целью понижения температуры используют дистилляцию с водяным паром или инертным газом. Процесс основан на законе Дальтона, согласно которому давление паров над смесью p равно сумме парциальных давлений паров компонентов. Если отгоняемое вещество А не смешивается с водой, то p = pA0 + pB (pA0 — давление пара чистого вещества А при температуре процесса; pB — давление водяного пара), то есть общее давление является линейной функцией pB, и вещество А можно отгонять при любой температуре, варьируя расход водяного пара или инертного газа Gуд. Последний определяется соотношением:

где MB и MА — молекулярная масса воды (инертного газа) и отгоняемого вещества; η < 1 — степень насыщения водяного пара или инертного газа парами отгоняемого вещества по сравнению с равновесной степенью насыщения.
При дистилляции в потоке водяного пара образуется паровая смесь, которая затем конденсируется и охлаждается. Конденсат разделяется в сепараторе на отогнанный компонент и воду. Целевой компонент выделяется из конденсата тем легче и полнее, чем меньше его растворимость в воде. Если она значительна, необходимо отогнанный из воды целевой компонент подвергать сушке. Этого удается избежать при использовании инертного газа. Однако, при этом усложняется выделение отгоняемого компонента из образующейся парогазовой смеси вследствие необходимости охлаждения ее до низкой температуры, а нагревание и охлаждение газа требуют применения теплообменных аппаратов с большой площадью поверхности из-за низкого коэффициента теплоотдачи от стенки к газу и от газа к стенке.
Поэтому данный метод применяется, когда дистилляция под вакуумом затруднительна или невозможна, и проводится в емкостных аппаратах, снабженных барботажными устройствами для равномерного распределения пара или газа по всему объему жидкости.
Выводы
Дистилляционные установки применяются в зависимости от требуемых параметров, каковыми являются количество (расход) и состав жидкой смеси, количество и состав дистиллята и кубового остатка, а также условия, определяющие требуемый коэффициент разделения смеси. Неизвестные параметры рассчитывают совместным решением уравнений материального баланса с учетом зависимости между составами контактируемых жидкости и пара. Данная зависимость определяется как физико-химическими свойствами жидких смесей, способами (простая или фракционная перегонка, ректификация, молекулярная дистилляция), так и условиями (периодический, непрерывный процесс) процесса дистилляции, а также его аппаратурным оформлением.
Следует отметить, что затраты при осуществлении процессов дистилляции связаны с большими затратами тепловой энергии, составляющими 40 % от стоимости разделяемого продукта (если проводить дистилляцию в вакууме, температура кипения понижается и дистилляция требует меньших тепловых затрат). В качестве источников тепловой энергии (особенно при дистилляции воды) могут быть использованы атомные и тепловые электростанции.

























