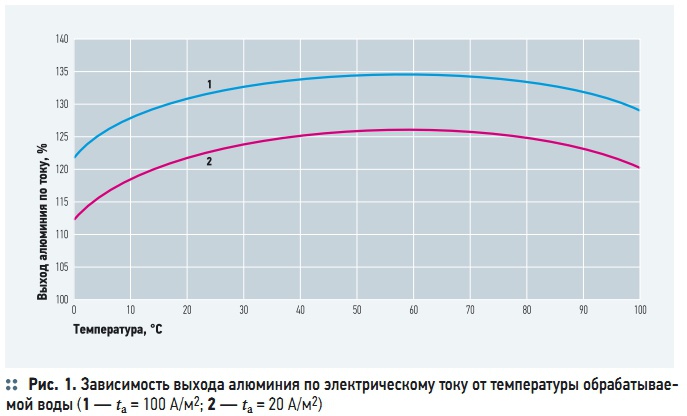
Рис. 1. Зависимость выхода алюминия по электрическому току от температуры обрабатываемой воды
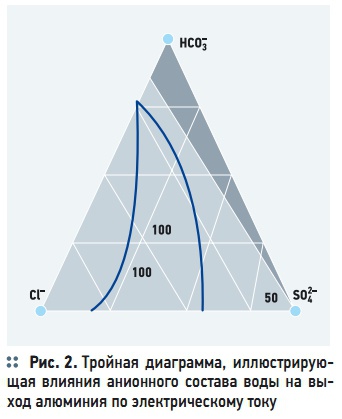
Рис. 2. Тройная диаграмма, иллюстрирующая влияния анионного состава воды на выход алюминия по электрическому току
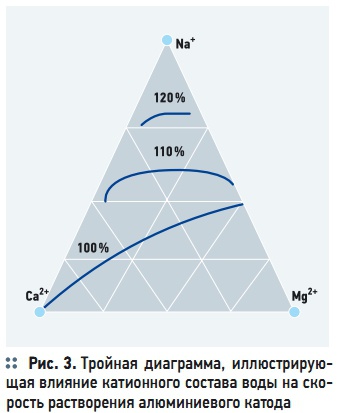
Рис. 3. Тройная диаграмма, иллюстрирующая влияние катионного состава воды на скорость растворения алюминиевого катода
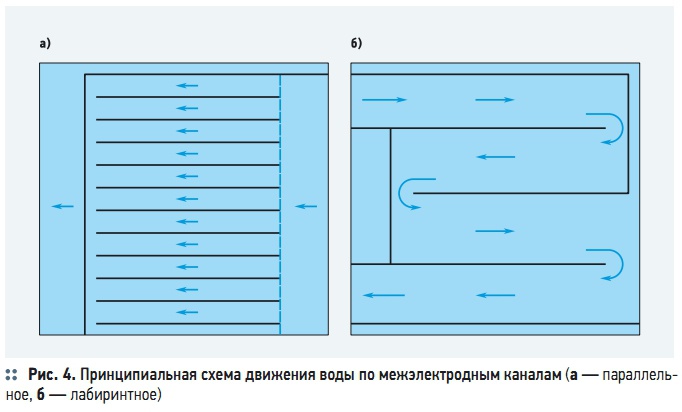
Рис. 4. Принципиальная схема движения воды по межэлектродным каналам

Рис. 5. Схемы электрокоагуляционных установок
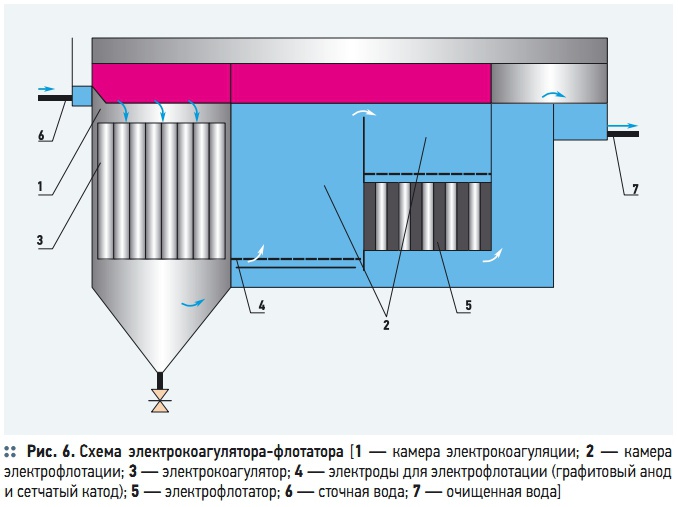
Рис. 6. Схема электрокоагулятора-флотатора
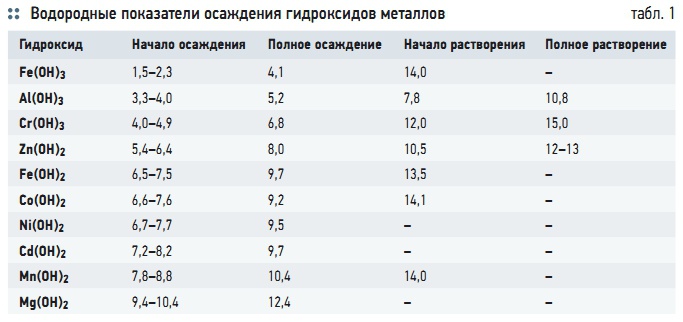
Табл. 1. Водородные показатели осаждения гидроксидов металлов
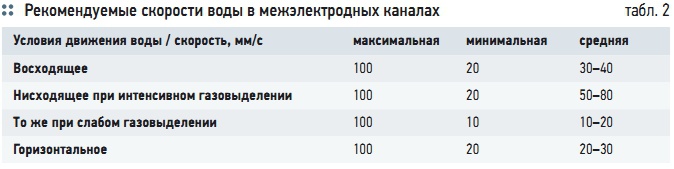
Табл. 2. Рекомендуемые скорости воды в межэлектродных каналах
Общие сведения
Электрокоагуляция — коагуляция (оседание) высокодисперсных коллоидных частиц и взвесей в виде гидроокисей металлов (алюминий, железо), генерируемых электрическим током за счет растворения металла анода (алюминиевого или железного) и воздействия постоянного электрического тока, который вызывает электролитическую диссоциацию растворенных в воде солей, а также селективное взаимодействие образующихся ионов с образованием и выпадением в осадок в виде нерастворимых гелей. Вследствие растворения анодов вода обогащается соответствующими катионами металлов, образующими затем в нейтральной и слабощелочной среде гидроокисью алюминия или гидрозакисью железа, которая под воздействием растворенного в воде кислорода переходит в гидроокись железа. Гидроокиси металлов обладают повышенной коагуляционной активностью и сорбционной способностью, что обеспечивает эффективную коагуляцию дисперсных примесей с участием продуктов электролиза.
Современная очистка сточных вод методом электрокоагуляции применяется на предприятиях машиностроительной и металлургической промышленности, где отработанная вода характеризуется высоким уровнем содержания солей тяжелых металлов, нерастворимых осадков, технических масел и нефтепродуктов. Электрокоагуляцию также можно применять для осветления и обесцвечивания воды, удаления из нее железа, кремния, хрома, СПАВ и радиоактивных веществ, а также для очистки воды от биологических загрязнений.
Наряду с электрокоагуляцией при наложении электрического поля происходит также: электролиз воды; поляризация коллоидных частиц; движение заряженных частиц в электрическом поле (электрофорез); окислительно-восстановительные процессы; химические реакции между ионами Аl 3+ или Fe2+, образующимися при электролитическом растворении металлических анодов и некоторыми содержащимися в воде ионами (S2 – , РO4 3– ); взаимодействие продуктов электролиза друг с другом; флотация твердых частиц пузырьками газообразного водорода, выделяющегося на катоде; сорбция ионов и молекул растворенных примесей на поверхности гидроксидов железа и алюминия, обладающих значительной сорбционной способностью [1].
Различают электростатическую, электрохимическую и гальваническую коагуляцию. Электростатическая коагуляция протекает за счет поляризации коллоидных частиц под влиянием внешнего электрического поля и слипания образовавшихся диполей. При этом возможно применение как постоянного поля, так и пульсирующего и знакопеременного. Для электростатической коагуляции требуются очень большие напряженности электрического поля, около 10–30 кВ/м, поэтому этот метод в водообработке сточных вод используется мало. Разновидностью электростатической можно считать электроконтактную коагуляцию, которая возникает при фильтровании воды в электрическом поле. В этом случае возможна частичная поляризация гидратированных ионов и коллоидных частиц под действием электрического поля с последующей коагуляцией диполей. Однако необходимые для коагуляции коллоидных частиц напряженности электрического поля очень велики, и этот способ применяется, в основном, для очистки обессоленных вод.
Электрохимическая коагуляция протекает за счет электролиза воды и изменения значения рН и окислительновосстановительного потенциала в объеме воды вблизи электродов. Электролиз производится с нерастворимыми электродами при электрическом напряжении на электродах, превышающем потенциал разложения воды (1,22 В).
Гальваническая электрокоагуляция протекает за счет электрохимического растворения в воде металлических электродов. В качестве материала электродов используют алюминий или сталь.
Механизм электрокоагуляции последовательно включает в себя следующие стадии: электрофоретическое концентрирование (направленное движение заряженных частиц примесей и концентрирование их у поверхности электродов); растворение электрода и образование гидроокисей металлов; поляризационная коагуляция дисперсных частиц; упаковка первичных агрегатов по мере накопления частиц гидроокисей; флокуляционная коагуляция; флотация образовавшихся агрегатов пузырьками газов [2].
На процесс электрокоагуляции оказывает влияние материал электродов, расстояние между ними, скорость движения сточной воды между электродами, ее температура и солевой состав, напряжение, сила и плотность электрического тока. С повышением концентрации взвешенных веществ более 100 мг/л эффективность электрокоагуляции снижается. С уменьшением расстояния между электродами расход энергии на анодное растворение металла уменьшается. Теоретический расход электроэнергии для растворения 1 г железа составляет 2,9 Вт⋅ч, а 1 г алюминия — 2 Вт⋅ч.
Степень использования металла электродов составляет 50–90 % и зависит от конструкции коагуляторов, материала анода и состава обрабатываемой воды.
Электрокоагуляцию рекомендуется проводить в нейтральной или слабощелочной среде содержащей не менее 20 % хлористых солей (от общего солесодержания) и не более 75 % гидрокарбонатов и сульфатов, вызывающих пассивацию электродов, при плотности электрического тока не более 10 А/м2, расстояния между электродами не должны превышать 20 мм, а скорости движения воды — не менее 0,5 м/с.
При наличии в воде больших количеств катионов Са2+ и Mg2+ и невозможности добавления к ней хлоридов в качестве катодного материала следует использовать нержавеющую сталь и не производить смену полярности электродов. Продолжительность электрообработки воды определяется свойствами загрязнений и в среднем может изменяться в пределах одной-пяти минут. Учитывая малое расстояние между электродами и возможность засорения электродного пространства, сточные воды перед электрокоагуляцией целесообразно подвергать механической сорбции от крупно диспергированных загрязнений.
Процессы при электрокоагуляции
Главной лимитирующей стадией электрокоагуляции является образование катионов металлов — результат электрохимического растворения металлических анодов в соответствии с уравнением:
M → Mn+ + ne–, (1)
где М — символ металла; n — его валентность. На алюминиевых анодах протекает следующая реакция:
Al → Al3+ + 3e–, (2)
а на анодах из стали идет реакция:
Fe → Fe2+ + 2e–, (3)
при этом часть катионов железа окисляется под действием растворенного в воде кислорода у анода до трехвалентного железа (III):
Fe2+ → Fe3+ + e–. (4)
Второй этап коагуляции сводится к химической гидратации образующихся катионов металлов, образовании нерастворимых гидроксидов металлов, их выпадении в осадок (кристаллизации) с последующим формированием хлопьев, способных флокулировать грубодисперсные примеси воды. Соответствующие химические реакции происходят в межэлектродном пространстве и включают несколько этапов:
Al3+ + 3 OH → Al(OH)3+, (5)
Fe3+ + 3 OH → Fe(OH)3+, (6)
Fe2+ + 2 OH → Fe(OH)2+, (7)
Fe(OH)2 + O2 + H2O → Fe(OH)3. (8)
В результате поступления в воду необходимого количества катионов железа или алюминия за счет приведенных выше реакций возникает та же ситуация, что и при обработке воды коагулянтами: солями железа или алюминия. Однако в отличие от применения солевых коагулянтов при электрокоагуляции вода не обогащается сульфатами или хлоридами, содержание которых в очищенной воде лимитируется как при сбросе ее в водоемы, так и при повторном использовании в системах промышленного водоснабжения.
Образование в воде многовалентных катионов понижает устойчивость отрицательно заряженных коллоидов, так как уменьшается толщина диффузионного слоя коллоидной частицы и понижается ее потенциал [3]. Устойчивость (стабильность) коллоидов обусловлена взаимодействием межмолекулярных сил взаимного притяжения и отталкивания, возникающих на границе соприкосновения двойных электрических слоев (ДЭС) сблизившихся частиц:
ΔU = U1 – U2, (9)
где U1 и U2 — соответственно силы отталкивания и притяжения. Если ΔU ≥ 0, укрупнение частиц невозможно, если ΔU ≤ 0 — произойдет слипание частиц, то есть коагуляция.
В электрическом поле создаются особенно благоприятные условия для коагуляции, чему способствует дополнительно возникающая сила диполь-дипольного воздействия U3, уменьшающего ДЭС и поляризующего коллоидные частицы:
ΔU = U1 – U2 – U3. (10)
Процесс коагуляции в электрокоагуляторах протекает значительно интенсивнее, чем при реагентной коагуляции, что объясняется положительным влиянием электрофореза на взаимное укрупнение зародышей частиц гидроксидов металлов и перемешиванием воды выделяющимися на катодах пузырьками водорода. Благоприятные условия электрокоагуляции позволяют уменьшить дозы металла, необходимые для очистки, по сравнению с дозами при реагентной коагуляции на 10–20 % и более.
Помимо использования электрокоагуляции для дестабилизации коллоидов и флокуляции грубодисперсных примесей, этот метод применим в схемах очистки воды от катионов тяжелых металлов. Это становится возможным в результате повышения значения рН воды (от 2,3 до 10,4) при электролизе, когда металлы переходят в состояние нерастворимых гидроксидов и осаждаются совместно с гидроксидами железа [4]. Значения водородных показателей, необходимых для осаждения тяжелых металлов, приведены в табл. 1. Значения рН зависят от концентрации осажденного иона. Большие значения рН относятся к меньшим концентрациям. Если при электролизе повышение рН оказывается недостаточным, необходимо увеличить водородный показатель воды перед электролизером путем подщелачивания за счет добавления в обрабатываемую воду щелочи.
Электрохимическое растворение металлов включает анодное растворение за счет внешнего электрического тока и химическое растворение анодов и катодов. Поэтому на практике выход металлов G по электрическому току может оказаться больше теоретически рассчитанного по формуле (11), определяемой законами Фарадея, и может составлять 120–130 % от теоретического выхода:
G = AIcurτ, (11)
где А — электрохимический эквивалент элемента: A = M/(26,8z) г/(А⋅ч); z — валентность; Icur — сила тока, А; τ — время обработки, ч.
Основными факторами, влияющими на электрохимическое растворение анода, являются: температура, сила и плотность электрического тока, значение рН, солевой состав воды, расстояние между электродами, скорость движения воды между электродами, концентрация взвешенных веществ. Повышение температуры воды при электрокоагуляции увеличивает выход металла по току, так как при этом интенсифицируются химические реакции, в том числе растворения металлов. Однако, как видно из рис. 1, положительное влияние роста температур наблюдается только до достижения некоторого температурного максимума (60– 80 °C), а дальнейшее повышение температуры снижает выход металла. В работе [5] это объясняется возрастающей интенсивностью пассивации алюминиевого анода за счет уплотнения и набухания коллоидальной гидроокиси алюминия в его микропорах.
Существенное влияние на соотношении количества металла, растворяемого электрохимическим и химическим путем, оказывает и значение рН. При рН = 6–8 в результате электрохимического процесса растворяется до 90 % алюминиевых анодов. Химическим способом растворяется около 70 % металла при рН = 6–8, в том числе 50 % при растворении катода. Суммарный выход алюминия по электрическому току возрастает в слабокислой и особенно щелочной среде, достигая 150–200 % [6]. Влияние водородного показателя на процесс растворения электродов связано с растворением пассивирующих отложений (табл. 1).
Влияние анионного состава водной среды на растворение анодов главным образом обусловлено условиями пассивации. Эффективным депассивантом является анион хлора (анодная поляризация). На рис. 2 показана диаграмма, иллюстрирующая роль основных анионов в процессе растворения алюминиевых электродов по выходу алюминия. Вершины треугольной диаграммы соответствуют 100 % содержанию трех основных анионов: хлор (Cl– ) – , сульфат (SO42+) — и гидрокарбонат (HCO3– ) — аниона. С уменьшением процентного содержания хлориона в водной среде выход алюминия по току уменьшается. На графике заштрихована критическая область возрастающей пассивации анода, в пределах которой анод становится практически нерастворимым (рис. 2).

На процесс химического растворения катода также влияет катионный состав водной среды. Диаграмма, иллюстрирующая влияние основных катионов — натрия, кальция и магния на химическое растворение алюминиевого катода приведена на рис. 3. Катионы натрия оказывают депассивирующее воздействие на катод. Напротив, катионы магния и особенно кальций, усиливают пассивацию катода (рис. 3). Другим фактором, оказывающим положительное влияние на выход катионов металлов, является плотность электрического тока, А/м2:
τ = I/Fэл. (12)
где I — величина электрического тока при электролизе, А; Fэл — площадь анода или катода, м2.
Оптимальными принимаются плотности электрического тока: для алюминиевых электродов, катодная плотность — tк = 10–35 А/м2, анодная — tа = 20–150 A/м2, а для железных электродов tа = tк = 10–100 A/м2. При плотности тока более 200 А/м2 растворение электродов сопровождается заметной электрофлотацией и усилением пассивации электродов. Периодическое переключение полюсов способствует депассивации электродов, что интенсифицирует их химическое растворение. Экспериментально установлено, что максимальный выход алюминия по току достигается при переключении полюсов через каждые 15 минут, то есть четыре раза в час [7]. На выход металла по току влияет и схема соединения электродов, при этом наибольший выход — при монополярном соединении.
Конструкции электрокоагуляторов
Электрокоагуляция осуществляется в специальных генерирующих катионы металла (чаще всего алюминия и железа) электрических приборах — электрокоагуляторах (рис. 4–5). Основной элемент электрокоагулятора — электродная камера со сменным набором стальных или алюминиевых (дюралюминиевых) электродов чередующейся полярности, в зазорах между которыми (шириной 5–20 мм) протекает обрабатываемая вода со скоростью не менее 0,5 м/с. Как и в электролизерах, в электрокоагуляторах электроды могут располагаться горизонтально или вертикально с зазором 10–16 мм, что зависит от условий размещения и монтажа, а также от расходов обрабатываемой воды. В электрокоагуляторах с меньшими плотностями электрического тока в связи с незначительным пенообразованием можно принимать ширину межэлектродных каналов менее 15 мм, и при обосновании не предусматривать устройств для удаления пены. При больших плотностях электрического тока ширина межэлектродных каналов должна принимается не менее 15–20 мм. Для удаления скоплений пены в каналах предусматриваются различные устройства, в частности, продувка сжатым воздухом.
Аноды и катоды выполняются в виде пластин из алюминия, его сплавов, не содержащих медь, или стали. Подключение пластин к источнику тока может быть параллельным или последовательным. В первом случае все электроды действуют как монополярные, во втором — промежуточные пластины работают биполярно. Последовательное же подключение позволяет работать при меньших значениях электрического тока. Наряду с пластинчатыми иногда используют засыпные электроды из стальной стружки. Несмотря на некоторые преимущества (большая поверхность, низкая стоимость), засыпные электроды применяются редко, поскольку они засоряются гидроксидами металлов и плохо регенерируются. Выбор материала для электродов зависит от технологических особенностей процессов очистки.
Если для коагуляции можно применить и алюминий и железо, выбор материала обосновывается технико-экономическими соображениями. Для коагуляции требуются большие дозы железа, чем алюминия, но для растворения 1 г железа затрачивается меньше электроэнергии. Теоретически, при расходе электроэнергии 26,8 А/ч в раствор переходит около 9 г металлического алюминия или же 28 г железа.
При низкой плотности тока необходимо увеличить необходимую продолжительность пребывания обрабатываемой воды в межэлектродном пространстве, ведь растворение анодов и хлопьеобразование протекают незначительно. Увеличение продолжительности пребывания воды достигается за счет увеличения длины межэлектродных каналов последовательным размещением электродных блоков по ходу движения воды или за счет ее рециркуляции. Для удлинения межэлектродных каналов их часто выполняют не по параллельной, а по последовательной (лабиринтной) схеме (рис. 4б).
Поскольку в результате объемных электрохимических процессов в межэлектродном пространстве формируются хлопья гидроокисей металлов, для их удаления устанавливают блок последующей очистки (отстойник, фильтр большой грязеемкости, флотатор), показанный на рис. 5. Электрокоагуляторы, работающие при низкой плотности электротока (менее 18–20 А/м2), целесообразно применять по схемам на рис. 5а и 5б, совместно с отстойниками и фильтрами большей грязеемкости. При более высоких плотностях электрического тока рекомендуется применять схему с флотатором (рис. 5в).
Блоки, состоящие из электрокоагулятора и флотационной камеры, называются электрофлотокоагуляторами (ЭКФ). Компоновка ЭКФ может предусматривать размещение электрокоагулятора в пределах флотационной камеры, и раздельно. Типовая конструкция, например, ЭКФ [8] имеет прямоугольную форму и состоит из трех отсеков: в первом отсеке размещается электрокоагулятор, во втором — электрофлотатор, третий отсек является отстойной камерой. Электроды, размещаемые в третьей секции, служат для обеззараживания воды (рис. 6).
Конструкцию электрокоагулятора следует выполнять с учетом условий замены электродов в случае их растворения, для очистки и депассивации. С целью интенсификации процесса электрокоагуляции может использоваться конструкция виброэлектрокоагулятора. Применение вибрационных колебаний среднего диапазона частот практически исключает пассивацию электродов, снимает диффузионные ограничения во всем рабочем объеме, облегчает удаление газов и образующихся осадков, выгружаемых периодически через специальный клапан без остановки аппарата.
Расчет электрокоагулятора
Производительность электрокоагулятора по количеству генерируемого растворенного металла является весьма важной расчетной величиной и должна соответствовать технологическим требованиям процесса электрохимической обработки воды.
Приведем последовательность расчета электрокоагулятора, предложенную Г. И. Воловником и М. И. Коробко [9]. Сначала вычисляется количество растворенного металла [г] при электрохимическом разложении электродов:
Gм = Дмqw τ, (13)
где Дм — доза металла, г/м3; qw — расчетная производительность электрокоагулятора, м3/ч; τ — период времени (принимается 1 час).
Дозы металла, необходимые для электрокоагуляции, определяются экспериментально. Ориентировочно можно принимать значения доз коагулянтов, известные из опыта реагентной обработки коагулянтами аналогичной по качеству воды, с введением коэффициента пересчета. Коэффициент должен учитывать повышенную эффективность электрокоагуляции, вид коагулянта, и приниматься равным 0,85–0,90. Пересчет с целью определения доз металлов по принятой дозе реагента производится путем умножения последней на коэффициент, который равен для Al2(SO4)3 — 0,158, для Al2O3 — 0,53, FeCl3 — 0,34, Fe2(SO4)3 — 0,28. Например, если для коагуляции природной воды с мутностью 200 г/м3 доза сернокислого алюминия равна 40 г/м3, то доза алюминия при электрокоагуляции составит величину:
40 × 0,85 × 0,158 = 5,4 г/м3.
Дозы металлического алюминия [мг/л], необходимые при электрокоагуляционном обесцвечивании воды, ориентировочно могут определяться путем корректировки формулы СНиП [10]:
Дм = 0,5√С, (14)
где Дм — доза коагулянта по Al2O3, г/м3; Ц — цветность исходной воды, град.
В результате одновременного растворения электродов расчетным электрохимическим и дополнительным химическим путями выход металла по току превышает 100 %, что учитывается введением повышающего коэффициента Км > 1 (по условиям процесса Км = 1,1–2,0, определяется экспериментально).
Расчетная производительность электрокоагулятора по металлу [г] определяется по формуле:
Gм = AмIcurτKмη, (15)
где η — коэффициент использования тока, принимается равным 0,7–0,9; Ам — электрохимический эквивалент металла, г/(А⋅ч) [11]. На основании формулы (15) сила тока [А], необходимая для генерации расчетного количества металла:

Площадь анодов [м2] вычисляется:
Fан = Icur /tан, (17)
где плотность анодного тока tан принимается равной 20–150 А/м2. Напряжения в электродной ячейке принимаются не менее 3 В для стальных и 4 В — для алюминиевых электродов.
По расчетной силе тока определяется общая площадь [м2] поверхности электродов составит:
Σfкат = Icur /ιкат, (18)
где ιкат — катодная плотность тока, А/м2. Площадь одной пластины (электрода), измеряемая в [м2], рассчитывается по следующей формуле:
fпл = lплbпл, (19)
где lпл и bпл — длина и ширина пластины, соответственно, м. Площади анодов и катодов принимаются одинаковыми, а количество пластин в электродной камере [шт.] рассчитывается по формуле:
nпл = Σfкат/fпл. (20)
Поскольку металлы генерируются у анода, в расчетах используется анодная плотность тока tан, которая задается экспериментально, в зависимости от продолжительности процесса электролиза при постоянном эффекте очистки воды, в пределах величины 100–300 А/м2 [12]. Минимальная ширина межэлектродных каналов равна:
Δmin = ΣWм.к /Σfпл, (21)
Ширина межэлектродных каналов принимается равной Δ = 0,015–0,02 м.
Вместимость межэлектродного пространства [м3] рассчитывается по формуле (22), и должна обеспечивать пребывание в них воды в течение промежутка времени τ1 ≥ 20–30 с:

В случаях, когда вместимость оказывается чрезмерно большой, предусматривается система с циркуляцией для поддержания требуемой скорости воды в межэлектродных каналах.
Производительность всего рециркулятора должна быть равна следующей величине, м3/ч:

где τ1 — расчетная продолжительность пребывания воды в межэлектродном пространстве, ч.
Скорость воды в межэлектродных каналах составит величину, мм/с:

Эта скорость должна быть достаточной для поддержания во взвешенном состоянии хлопьев гидроксидов металлов. Рекомендуемые скорости воды в межэлектродных каналах [13] приведены в табл. 2. Если вместимость межэлектродного пространства недостаточна для требуемой продолжительности пребывания воды в зоне электролиза, применяется установка периодического действия.
Необходимая продолжительность электролиза обеспечивается многократным пропуском воды через имеющийся электролизер. Число таких пропусков определится как:
m = qwτ1/Wм.э. (25)
При проектировании электрокоагулятора-флотатора также необходимо рассчитать достаточное количество выделяемого при электролизе воды газообразного водорода по условиям флотации. Расчетное количество выделяемого водорода [л/кг] определяется по формуле:
Qрн = qуднКСenЭqw × 10–3 , (26)
где qудн — удельное потребление водорода, требуемое для извлечения единицы массы загрязнений, л/кг; К — понижающий коэффициент, который учитывает интенсификацию процесса агрегации газовых флокул при электролизе, К = 0,7–0,8; Сen — концентрация загрязнения в исходной воде, мг/л; Э — принятый в расчете эффект очистки, доли ед.; qw — удельное потребление воды, л/кг. Фактическое количество выделяемого водорода:
Qфн ~ 0,4Icur, (27) где Icur — cила электрического тока, А. Эта зависимость получена путем преобразования формулы:

Если количество выделяющегося водорода оказывается недостаточным, то дополнительно предусматривается установка блока нерастворимых электродов, которые размещаются после блока для электрокоагуляции непосредственно в корпусе электрокоагулятора или камеры флотации. Дополнительный электродный блок рассчитывается на генерирование количества водорода:
ΔQн = Qрн – Qфн. (29)
Концентрация загрязнений в воде определяется по формуле, мг/л:
Cp = Cen + ΔC, (30)
где Сen — содержание грубодисперсных примесей в исходной воде, мг/л; ΔС — содержание в воде продуктов электрокоагуляции, мг/л:
ΔС = KмДм, (31)
где Км — коэффициент пересчета содержания гидроокисей на твердую массу осадка согласно химическим реакциям гидратообразования. Для алюминия Км = 2,89, для трехвалентного железа — 1,91, для двухвалентного железа — 1,62.
Эксплуатационный расчет установок
Эксплуатационные работы включают: усреднение по расходам и качеству воды, поступающей в электрокоагулятор; корректировку качества воды (очистка от грубодисперсных примесей, корректировка рН и солевого состава); поддержание расчетного режима рециркуляции воды в контуре электрокоагулятора, если это предусмотрено схемой обработки; контроль значений и поддержание на нужном уровне электрических параметров — силы тока, напряжения; соблюдение режима переполюсовок электродов для депассивации и способа равномерного растворения всех электродов; очистку межэлектродного пространства от отложений и пены; удаление образующейся при электролизе пены; своевременную замену электродов; контроль за состоянием газовой среды и обеспечение эффективной работы системы вентиляции; правильное содержание сооружений для последующей очистки воды (отстойники, флотаторы, фильтры).
Продолжительность периода использования электродов (рабочего цикла) принимается в пределах 500–1000 ч:

где Gпл — масса электродных пластин, кг; Дм — доза металла, г/м3; Кисп — коэффициент использования электродов (обычно принимается 0,8–0,9).
Общая масса электродных пластин:
Gпл = 0,5αΣf (γ1d1 + γ2d2), (33)
где Σf — суммарная площадь поверхностей анода и катода, м2; d1 и d2 — толщины пластин соответственно анодов и катодов, м; γ1 и γ2 — плотности материалов анодов и катодов, соответственно (железа — 7600, титана — 4500, алюминия — 2700, графитизированного угля и графита — 2100 кг/м3). Рекомендуемые параметры электрокоагуляторов: материал электродов — алюминий или железо; расстояние между вертикально устанавливаемыми пластинами электродов — 15–20 мм; электрическое напряжение на электродах — 6 В; плотность тока — 30/40 А/м2 для алюминиевых/стальных электродов; продолжительность пребывания воды в межэлектродном пространстве — 3–5 мин.; доза железа и алюминия составляет 15 и 7 г/м3.
Заключение
Основными преимуществами электрокоагуляционного метода по сравнению с реагентными являются компактность установки, относительная простота ее эксплуатации и резкое сокращение расходов на химические реагенты. Наряду с электрокоагуляцией также происходит и бактерицидная обработка воды.
Недостатками является расход металла (алюминия и железа) и электроэнергии. Теоретически, для растворения 1 г железа и 1 г алюминия расходуется 3 и 12 Вт⋅ч, соответственно. Фактический же расход электроэнергии оказывается выше из-за затрат на нагревание воды, поляризацию электродов, преодоление электрического сопротивления оксидных пленок, образующихся на поверхности растворяемых анодов, и т.п.
Для осуществления электрокоагуляции требуются значительные затраты электроэнергии и листовой металл, поэтому ее можно рекомендовать для локальных схем очистки небольших количеств сточных вод (50–80 м3/ч). Электрокоагуляция эффективна для удаления из сточных вод тонко диспергированных примесей, эмульсий, масел и нефтепродуктов, органических взвесей и т.д. Рекомендуется применять этот метод для очистки сточных вод с нейтральной или слабощелочной реакцией (pH = 6–9).


























