
Электропроводность воды — это важнейший параметр её качества, который может быть определён самым простым и доступным способом. Электропроводность зависит от количества растворённых в воде солей, кислот и оснований, то есть от количества ионов. Соответственно, величина электропроводности зависит от концентрации ионов в воде. Чем выше концентрация, тем больше электропроводность. Таким образом, по значению этого параметра можно определить общее солесодержание воды.
Следует отметить, что электропроводность воды, то есть её способность к переносу электрического заряда (электронов), определяется ионами и называется ионной. Если поместить в воду два электрода и включить их в схему с источником тока, то его протекание между ними будет определяться перемещением ионов от одного к другому. Очевидно, что разные ионы будут иметь разную способность к перемещению, или, как принято говорить, они имеют различную подвижность. Последняя в основном определяется условиями взаимодействия ионов с растворителем (водой). Наглядно этот процесс можно представить довольно просто. Если растворить в воде хлорид натрия, то образуются катионы натрия, имеющие положительный заряд, и анионы хлорида, имеющие отрицательный заряд. Катион и анион вступают во взаимодействие с молекулами воды и гидратируются ею, то есть ионы, имеющие заряд, притягивают дипольные молекулы воды.

Способность к удержанию гидратной оболочки у разных ионов различная. Здравый смысл говорит о том, что чем больше валентность иона и чем больше его атомная масса, тем большей способностью к удержанию гидратной оболочки он обладает. Катион натрия в гидратной оболочке осуществляет перенос электрона в воде от одного электрода к другому. При этом натрий является одновалентным и, соответственно, переносит только один электрон. Ион хлорида тоже переносит только один электрон. Если в воде растворить хлорид кальция, то двухвалентный ион кальция в гидратной оболочке сможет переносить уже два электрона. Соответственно, за один раз ион натрия переносит один электрон, а ион кальция — два. Получается, что способность иона кальция к переносу электрического заряда должна быть в два раза больше, чем иона натрия. На самом деле всё так и есть.
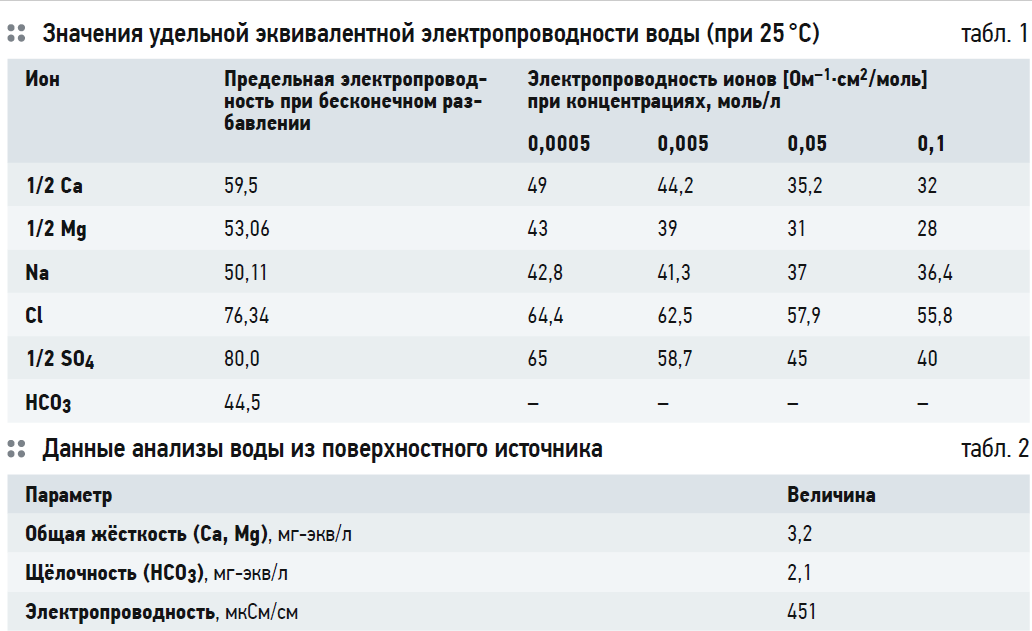
В табл. 1 представлены значения удельной эквивалентной электропроводности (подвижности ионов) в Ом-1· см²/моль при 25°C. Из табл. 1 видно, что подвижности ионов кальция и натрия, при бесконечном разбавлении их в воде (отсутствие влияния ионной силы раствора), практически равны (59,5 и 50,11). Таким образом, подвижность эквивалентного количества кальция по отношению к натрию составит 59,5×2 = 119, а подвижность натрия останется 50,11. Получается, что определённое количество молей кальция может перенести более чем в два раза больше электрического заряда, чем такое же количество молей натрия. Это правило соблюдается для ионов любой валентности.
Можно заметить, что чем больше молярная масса иона и больше его валентность, тем больше он теряет подвижность при увеличении концентрации ионов в воде. Потерю подвижности ионов при увеличении их концентрации в растворе можно сравнить с человеком, который пересекает площадь, когда на ней нет людей, и делает то же самое, когда на площади находится толпа народу. Когда «людей» нет, тяжёлые многовалентные ионы имеют преимущество перед одновалентными при пересечении площади. Когда на ней толпа, то многовалентный ион, как большой человек с раскинутыми руками, значительно сильнее тормозится остальными людьми, чем небольшой человек с одной вытянутой рукой.
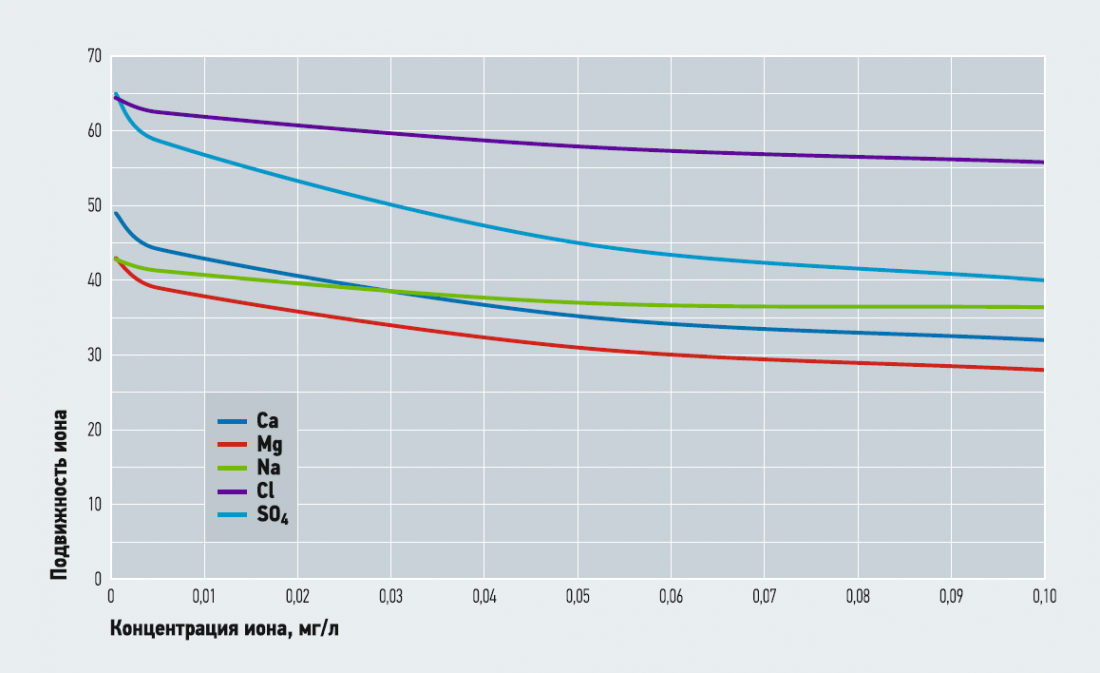
Рис. 1. Падение подвижности ионов при увеличении концентрации растворов
На рис. 1 представлены графики изменения подвижности ионов в воде в зависимости от их концентрации. Фактически это графическое отображение табл. 1. Можно видеть, что наибольшее падение подвижности имеет самый тяжёлый двухвалентный ион сульфата, далее — одинаковое уменьшение подвижности имеют двухвалентные ионы кальция и магния, и наименьшая потеря — у одновалентных ионов натрия и хлорида. Таким образом, зная значение электропроводности воды, можно определить концентрацию ионов в ней. Но здесь возникает вопрос: «Как достоверно определить солесодержание воды (общую массу ионов в воде, отнесённую к 1 л), если в жидкости содержится не одна конкретная соль, а несколько?».
Для очень приблизительного определения солесодержания воды по электропроводности используют упрощение, которое предполагает, что вся соль в воде содержится в виде хлорида натрия. Хлорид натрия, растворённый в воде, имеет коэффициент пересчёта электропроводности в солесодержание 0,5–0,55 в зависимости от значения солесодержания воды. Если этот параметр меньше 1 г/л, то используют коэффициент пересчёта 0,5. Чем больше солесодержание, тем выше коэффициент пересчёта. При 16 г/л NaCl коэффициент пересчёта будет 0,57.
Соответственно, для пресных вод (поверхностных и подземных) предполагается, что вся соль — это хлорид натрия, и измеренная величина электропроводности умножается на 0,5–0,55.
На самом деле практически все пресные поверхностные воды и большинство подземных имеют в своём составе преимущественно соли карбонатной и некарбонатной жёсткости. Непосредственно доля хлорида натрия в поверхностных водах редко когда бывает больше 10–20% от общего ионного состава.
В этих условиях использование коэффициента пересчёта 0,5–0,55 приводит к существенной погрешности в определении солесодержания [мг/л]. Конечно, принципиально можно определить, питьевая это вода или нет, и, например, работает ли установка обессоливания воды. Но погрешность составит примерно 25–30%. Это не позволяет ориентироваться на общее солесодержание воды исходя из электропроводности. Соответственно, необходимо делать анализ на все ионы, входящие в состав источника воды.
Например, в табл. 2 приведены самые доступные и простые данные анализа воды из поверхностного источника на такие параметры, как общая жёсткость, щёлочность и электропроводность.

В результате, ориентируясь на солесодержание воды по электропроводности, получено следующее значение солесодержания S = 451×0,5 = 225,5 мг/л (0,5 — коэффициент пересчёта для NaCl). Концентрация бикарбоната кальция Са(НСО3)2 равна (2,1/2)×162 = 170,3 мг/л, где 162 — молярная масса бикарбоната кальция [г/моль]. Если принять, что остальная соль в воде представлена хлоридом кальция (СаСl2), то получим СаСl2 = [(3,2–2,1)/2]×111 = 61,05 мг/л, где 111 — молярная масса хлорида кальция. Итого: 170,3 + 61,05 = 231,35 мг/л.
Формально солесодержания равны. На самом деле полный анализ воды показал, что в данной жидкости содержится 60 мг/л сульфатов и 25 мг/л натрия. Итого солесодержание воды, рассчитанное по ионному составу, получилось 312 мг/л. Получается, что значение солесодержания по электропроводности определяет в воде только часть солей при использовании коэффициента пересчёта 0,5–0,55.
Погрешность в измерениях по электропроводности составила почти 30%. Для воды данного состава коэффициент пересчёта электропроводности в солесодержание должен быть 0,69. Это значение значительно отличается от общепринятой величины 0,5–0,55.
Далее произведём несложные расчёты электропроводности воды, состав которой представлен в табл. 2, 3, и сравним со значением измеренной электропроводности по кондуктометру — 451 мкСм/см.
Для расчёта используем данные источника [1].
Электропроводность воды по мольной концентрации в ней конкретного типа соли можно определить по формуле:
μ = 1000Cμ0(1 — aКОРЕНЬ[C]) + bC), (1)
где μ — электропроводность соли, мкСм/см; С — концентрация соли, моль/л; μ0 — предельная электропроводность соли при бесконечном разбавлении; a и b — коэффициенты, разные для каждого вида соли, берутся по данным [1].
По формуле (1) были определены значения электропроводности воды для хлорида кальция. Для бикарбоната кальция пересчёт солесодержания в электропроводность был произведён на основании графиков [1]. Результаты расчёта представлены в табл. 3.
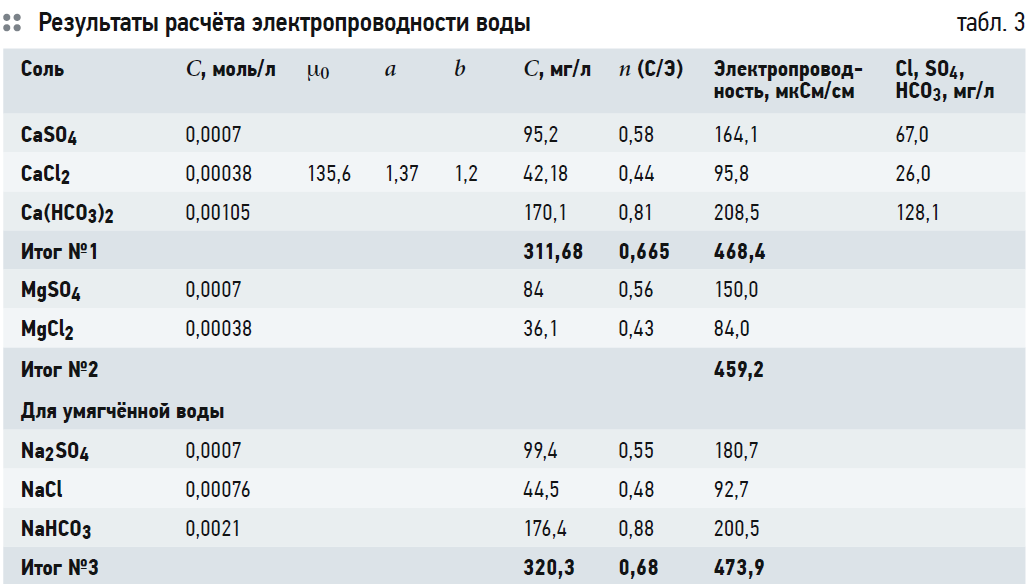
В табл. 3 представлены концентрации соответствующих солей в [моль/л], полученные в результате анализа.
Затем, путём умножения на молярную массу, были получены значения концентрации соли в воде в [мг/л]. Далее на основании формулы (1) и графиков [1] была рассчитана электропроводность водного раствора каждой соли, а затем вычислен коэффициент пересчёта электропроводности в солесодержание n путём деления второго на первое.
Если принять, что в исходной воде в качестве катионов содержится только кальций, то в результате расчёта получается значение электропроводности воды, равное 468,4 мкСм/см. Это больше, чем измеренное значение электропроводности (451 мкСм/см). При учёте солей магния, точнее, их доли, расчётная электропроводность составила 459,2 мкСм/см. При этом солесодержание воды было 311 мг/л, а коэффициент пересчёта — 0,665. Как мы видим, реальный коэффициент значительно больше, чем 0,5.
При анализе табл. 3 выясняется, что основное влияние на коэффициент пересчёта электропроводности в солесодержание оказывает анионный состав — прежде всего концентрация бикарбонатов (из-за большого коэффициента пересчёта n = 0,8–1,0). Можно сказать, что для карбонатных, кальциево-магниевых вод коэффициент пересчёта электропроводности в солесодержание должен быть в диапазоне 0,6–0,75. И только для хлоридных и сульфатных вод (при любом катионном составе) коэффициент пересчёта составит 0,5–0,55.
Для ориентировочного определения коэффициента пересчёта электропроводности в солесодержание необходимо знать только значение электропроводности, жёсткости и щёлочности (HCO3) воды. Для ориентировочного определения коэффициента пересчёта электропроводности воды в солесодержание (карбонатно-кальциевой воды) имеется формула:
n = (nHCO3qHCO3 + nSO4,ClqSO4,Cl) — 0,05,
где nHCO3 — коэффициент пересчёта для бикарбоната кальция, принимается nHCO3 = 0,86; nSO4,Cl — коэффициент пересчёта для сульфата кальция, nSO4,Cl = 0,53; qHCO3 — доля бикарбоната от суммы всех анионов в г-экв; qSO4,Cl — доля суммы сульфата и хлорида от всех анионов.

Пример. Имеется вода карбонатно-кальциевого типа, её электропроводность — 550 мкСм/см; жёсткость — 4,5 мг-экв/л; щёлочность — 2,7 мг-экв/л. Предполагается отсутствие в воде одновалентных катионов. Соответственно, концентрация анионов предполагается равной 4,5 мг-экв/л, тогда:
qHCO3 = 2,7/4,5 = 0,6;
qSO4,Cl = 1–0,6 = 0,4;
n = (0,86×0,6 + 0,53×0,4) — 0,05 = 0,678.
Соответственно, солесодержание воды будет равно S = 550×0,678 = 373 мг/л.
Реальная величина коэффициента пересчёта для данной воды составила 0,665. Погрешность при использовании данной формулы для карбонатно-кальциевых вод составляет не более 0,05.
Вторая часть данной статьи посвящена вопросу изменения солесодержания воды в процессе её умягчения.
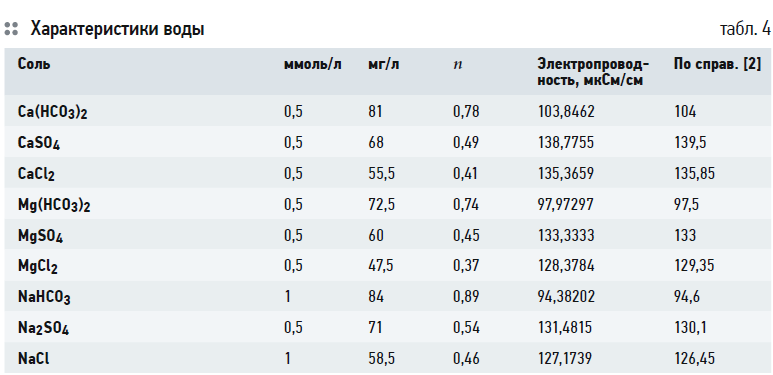
Для понимания, как изменяется солесодержание и электропроводность умягчённой воды, давайте рассмотрим данные табл. 4. В этой таблице представлены данные для расчёта коэффициента пересчёта каждой соли.
Методика пересчёта следующая:
1. По справочнику [2] определяются молярные электропроводности ионов в воде при бесконечном разбавлении. Например, электропроводность кальция при бесконечном разбавлении равна 59,5 мкСм/см, бикарбоната — 44,5 мкСм/см. Получаем 59,5 + 44,5 = 104 мкСм/см. Производим такие расчёты для всех солей.
Результаты расчёта записываем в последний столбец табл. 4.
2. Задаёмся молярной концентрацией солей так, чтобы концентрации всех солей были эквивалентно равны. То есть для двухвалентных солей — 0,5 ммоль/л, для одновалентных — 1 ммоль/л. Значения записываем в первый столбец.
3. Умножая на молярную массу каждой соли, получаем концентрацию соли в мг/л. Это третий столбец.
4. Делим значение из третьего столбца на значение из последнего столбца и получаем величину коэффициента пересчёта n для каждой соли.
5. Округляем значение n до второго знака после запятой и умножаем на значение столбца 3.
Как можно видеть, электропроводность любых эквивалентных концентраций солей одного аниона уменьшается с уменьшением заряда и атомной массы катиона. Например, значение электропроводности бикарбоната кальция — самое большое по сравнению с бикарбонатом магния и натрия. Кальций двухвалентный и имеет самую большую массу. Затем следует бикарбонат магния. И самая маленькая электропроводность из бикарбонатных солей у одновалентного натрия. И это при том, что в эквивалентных концентрациях натрия в два раза молей больше, чем кальция или магния.
Такая же последовательность наблюдается и для других анионов.
Получается, что при бесконечном разбавлении раствора двухвалентные ионы переносят больше электрического заряда. Но эксперименты подтверждают, что умягчённая вода, которая содержит только натриевые соли в концентрациях, эквивалентных исходным кальциевым и магниевым солям, практически всегда имеет более высокую электропроводность. Это связано с тем, что в реальных растворах гидратированные ионы сталкиваются друг с другом, как выше было образно сказано «переходят площадь, на которой толпа людей» (то есть других ионов). В этом случае наблюдается значительное уменьшение переноса электрического заряда двухвалентными ионами. Уже при концентрации в несколько [мг/л] наблюдается значительное падение их электропроводности.
Для того, чтобы наглядно показать это, автор провёл несколько экспериментов по умягчению жёсткой воды.
Было приготовлено четыре раствора.
Два раствора CaCl2 с электропроводностью 1168 и 339 мкСм/см. Два раствора MgSO4 с электропроводностью 1169 и 355 мкСм/см. Затем было проведено умягчение всех растворов и сделано измерение их электропроводности. Для умягчения использовалась ионообменная колонка с катионитом, а для измерения электропроводности — поверенный кондуктометр с погрешностью не более 1,5% от измеренной величины.

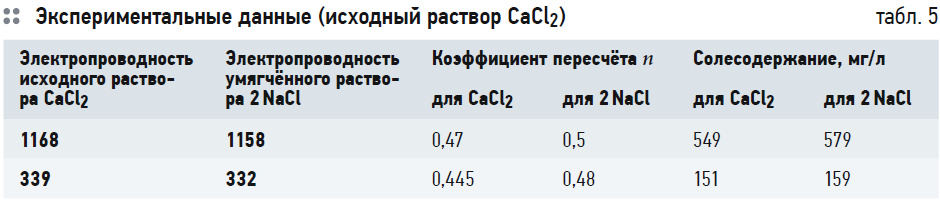
Результаты эксперимента приведены в табл. 5 и 6. Из данных табл. 5 видно, что электропроводность исходного раствора хлорида кальция больше, чем тот же параметр полученного в результате умягчения раствора хлорида натрия. Причём разница в электропроводности исходной и умягчённой воды уменьшается незначительно даже при увеличении солесодержания в четыре раза. Это подтверждает тот факт, что одновалентные ионы хлорида незначительно теряют подвижность с ростом общего количества ионов.
Коэффициент пересчёта меняется незначительно, как для хлорида кальция, так и для хлорида натрия. Но, так как кальций двухвалентный, он больше теряет подвижность с ростом солесодержания, и, соответственно, коэффициент пересчёта для хлорида кальция вырастает на 0,47–0,445 = 0,025. При том, что коэффициент пересчёта для хлорида натрия вырастает всего на 0,5–0,48 = 0,02.

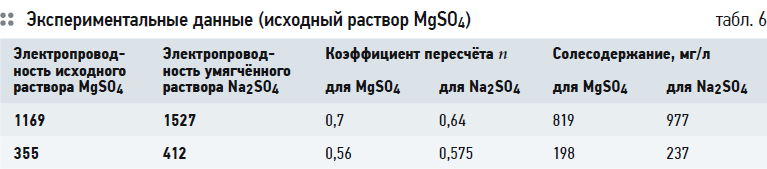
Из данных табл. 6 видно, что электропроводность исходного раствора сульфата магния меньше, чем электропроводность полученного в результате умягчения раствора сульфата натрия. Причём чем больше электропроводность (солесодержание) раствора, тем больше разница между электропроводностью умягчённой и исходной воды. Это говорит о том, что тяжёлый, двухвалентный ион сульфата при увеличении солесодержания воды значительно теряет подвижность. В связи с этим коэффициент пересчёта n вырастает от 0,56 до 0,7 при увеличении солесодержания всего в 3,5 раза.
Эксперимент подтверждает ключевое влияние величины солесодержания и двухвалентных ионов на увеличение электропроводности умягчённой воды по сравнению с исходной.
Мною был проведён эксперимент по умягчению водопроводной воды с жёсткостью 3,2 мг-экв/л и электропроводностью 451 мкСм/см. Результаты измерений представлены на рис. 2.
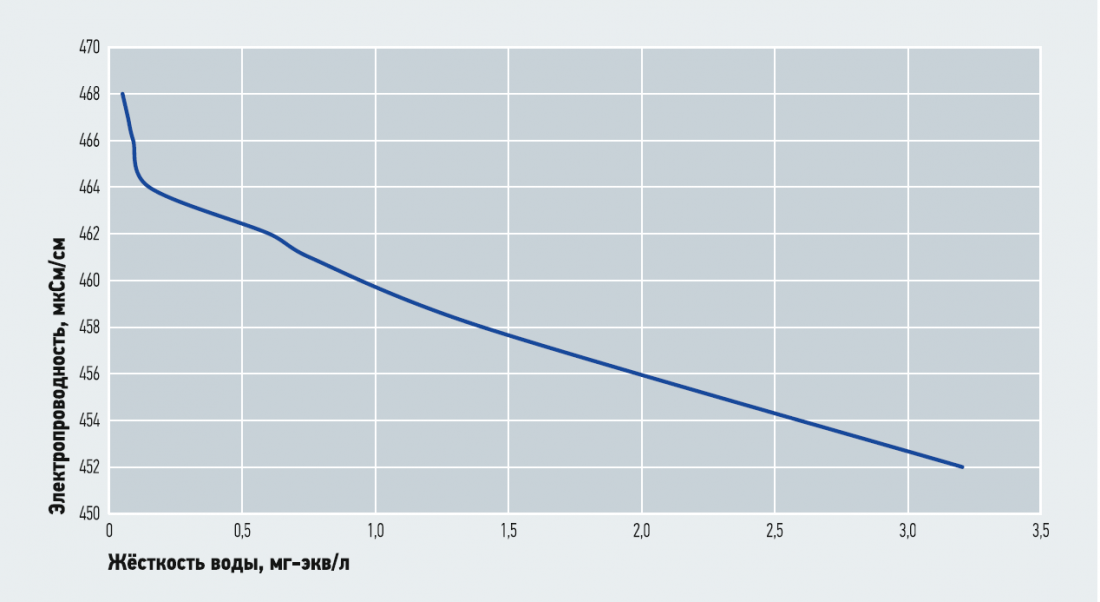
Рис. 2. Зависимость электропроводности умягчённой воды от её остаточной жёсткости
Как видно из рис. 2, жёсткость умягчённой воды сразу после начала фильтрования составила 0,05 мг-экв/л, а электропроводность — 468 мкСм/см. Затем электропроводность начала падать, и при значении 464 мкСм/см жёсткость составила 0,1 мг-экв/л. Далее началось существенное падение электропроводности и значительное повышение жёсткости. Причём падение первого носит линейный характер по отношению ко второму.
Можно сказать, что до значения электропроводности 464 мкСм/см умягчение воды проходило в объёме фильтроцикла до истощения катионита по ионам натрия. После этого истощения электропроводность упала ниже 464 мкСм, и жёсткость фильтрата выросла недопустимо для первой ступени умягчения. Когда катионит потерял способность к ионообмену, электропроводность исходной воды стала равна таковой у «умягчённой».
Интересное наблюдение. При умягчении воды в самом начале фильтроцикла, когда катионит гарантированно был насыщен ионами натрия, электропроводность полученного фильтрата держалась на уровне 467 мкСм/см, что соответствовало величине жёсткости умягчённой воды 0,05 мг-экв/л. Затем была значительно увеличена скорость фильтрования, которая была гарантированно больше 100 м/ч. При этом даже насыщенный катионит не успевал полностью умягчать воду, и электропроводность воды снизилась до 461 мкСм/см, что соответствует 0,75 мг-экв/л жёсткости. Затем скорость была восстановлена до значений от 20 до 25 м/ч. Электропроводность снова выросла до 467 мкСм/см.
Это было сделано для того, чтобы исключить возможное влияние на электропроводность фильтрата возможных остатков регенерационного раствора и чётко определить верхнюю границу электропроводности умягчённой воды.
В табл. 3 представлены данные расчёта электропроводности воды, содержащей бикарбонат натрия, хлорид натрия и сульфат натрия (умягчённой воды, для которой проводился эксперимент).
Мольная концентрация бикарбоната натрия будет в два раза больше того же показателя исходного бикарбоната кальция, так как 1 моль карбоната кальция эквивалентно замещается двумя молями бикарбоната натрия. Так же — для хлорида натрия. Мольная концентрация сульфата натрия будет равна аналогичному показателю сульфата кальция.
По данным [1] были определены значения коэффициентов пересчёта солесодержания в электропроводность для натриевых солей. Затем была рассчитана электропроводность каждой из них. В результате сумма электропроводностей всех солей составила 473,9 мкСм/см.
В результате расчёта определено, что электропроводность жёсткой воды составила 459,2 мкСм/см, а умягчённой — 473,9 мкСм/см. Расчётная электропроводность умягчённой получилась немного выше, чем расчётная электропроводность жёсткой. Это соответствует реальным показателям электропроводности на рис. 2.
Так как в природной воде всегда содержится кальций и магний, а также не менее 70% от суммы всех анионов составляет бикарбонат + сульфат, то электропроводность умягчённой воды в подавляющем большинстве случаев будет выше электропроводности жёсткой воды, поступающей на умягчение.
Только в том случае, если в исходной жёсткой воде не будет бикарбоната и сульфата, то после умягчения такой жидкости электропроводность уже умягчённой будет ниже электропроводности исходной жёсткой при солесодержании исходной воды не более 1 г/л.
Необходимо отметить, что чем выше солесодержание исходной воды и, соответственно, жёсткость, тем больше будет разница в значениях электропроводности жёсткой и умягчённой. Электропроводность умягчённой воды будет расти прямо пропорционально увеличению жёсткости и, соответственно, солесодержанию исходной жидкости. Как было показано выше, при более высоком солесодержании воды бóльшую подвижность будут иметь одновалентные ионы натрия по сравнению с двухвалентными ионами кальция и магния.
Можно видеть, что экспериментальные данные подтверждают данные расчётов. Для воды с исходной жёсткостью 3,2 мг-экв/л и величиной электропроводности 459,2 мкСм/см перепад электропроводности составил в среднем 15 мкСм.
Анализируя электропроводности различных вод до и после установок умягчения на различных объектах, автор установил определённую закономерность в изменении электропроводности исходной и умягчённой воды.
Увеличение электропроводности воды, умягчённой по сравнению с жёсткой, составляет примерно от 15 до 25 мкСм на 3 мг-экв/л жёсткости. Конечно, необходимо помнить, что данная зависимость характерна только для пресных, слабосолёных, карбонатно-сульфатных поверхностных и подземных вод.
Далее пример из практики автора.
Электропроводность исходной воды до умягчения составляла 1692 мкСм/см и жёсткость — 11,5 мг-экв/л. После умягчения воды её электропроводность составила 1795 мкСм/cм. Увеличение электропроводности составило 103 мкСм/см. Данная величина довольно существенна и позволяет вести контроль за установкой умягчения даже при использовании довольно дешёвого кондуктометра.
Выводы
1. Коэффициент пересчёта электропроводности в солесодержание n зависит прежде всего от анионного состава воды и общей концентрации ионов в ней.
2. Для вод с содержанием бикарбоната от 30 до 80% и более коэффициент пересчёта должен определяться в диапазоне от 0,6 до 0,75.
3. Использование коэффициента пересчёта 0,5–0,55 обосновано только для хлоридно-сульфатных вод. В большей степени — хлоридных.
4. Для ориентировочного определения коэффициента пересчёта электропроводности в солесодержание (карбонатно-кальциевой воды) можно воспользоваться следующей формулой:
n = (nHCO3qHCO3 + nSO4,ClqSO4,Cl) — 0,05,
где nHCO3 — коэффициент пересчёта для бикарбоната кальция, nHCO3 = 0,86; nSO4,Cl — коэффициент пересчёта для сульфата кальция; nSO4,Cl = 0,53; qHCO3 — доля бикарбоната от суммы всех анионов в молях; qSO4,Cl — доля суммы сульфата и хлорида от всех анионов.
5. Увеличение электропроводности умягчённой воды по сравнению с исходной жёсткой для карбонатно-кальциевых вод происходит прежде всего за счёт присутствия в воде кальция, магния и сульфата и величины общего солесодержания. Чем выше жёсткость исходной, тем больше разница между электропроводностями умягчённой и жёсткой воды.
6. При умягчении воды вполне допустимо осуществлять постоянный автоматический контроль этого процесса измерением электропроводности исходной и умягчённой жидкости. При этом чем выше жёсткость исходной воды, тем эффективнее процесс контроля по электропроводности. При водоподготовке для паровых и водогрейных котлов использование данного метода вполне оправдано в качестве дополнительного.
Для технологий, не подразумевающих повышенных требований к жёсткости воды, данный метод контроля вполне применим как основной. Например, для получения питьевой воды или для использования умягчения в качестве предварительной ступени водоподготовки (например, перед осмосом).

























