При рассмотрении показателя стабильности воды часто упоминается такая величина, как «агрессивная углекислота». Как известно, в природной воде всегда содержится растворённый углекислый газ, находящийся в состоянии динамического равновесия как с воздушной средой согласно закону Генри-Дальтона, так с производными диссоциации угольной кислоты — гидрокарбонат[НСО32–] и карбонат-ионами [СО32–]. При этом угольная кислота и её производные в природных водах преобладают среди слабых кислот. В то же время преобладающими катионами в природных водах являются Ca2+, Mg2+, Na+, Fe2+, Fe3+, Из всех солей, которые могут быть образованы катионами и анионами НСО32– и СО32–, наименьшей растворимостью (произведением растворимости — ПР) в воде обладает карбонат кальция CaCO3, вокруг образования или растворения которого и строится задача определения стабильности воды.
Так как непосредственно СО2 в формулу произведения растворимости СаСО3 не входит, то и формально не влияет на стабильность воды. При этом в литературе (например, в [1]) можно встретить следующее уравнение между различными формами угольной кислоты:
2 НСО3– ↔ СО32– + СО2 + Н2О. (1)
Согласно устоявшемуся мнению, для поддержания в растворе определённой концентрации гидрокарбонатных ионов требуется соответствующее этой концентрации количество угольной кислоты — это количество и называется «равновесной углекислотой».
Если количество находящегося в растворе углекислого газа превышает равновесное, то избыток СО2 способен вступать в реакцию с твёрдым карбонатом кальция и вызывать его растворение:
СаСО3 + СО2 + Н2О ↔ Са(НСО3)2. (2)
Воду, содержащую свободную углекислоту в концентрации, превышающей равновесную, называют «агрессивной».
Наоборот, при недостатке СО2 по сравнению с равновесной концентрацией возникает тенденция к распаду части гидрокарбонат-ионов, то есть к сдвигу равновесия в уравнении (1) вправо с образованием дополнительного количества СО2 и одновременно СО32–, что в свою очередь приводит к реакции:
Са2+ + СО32– = СаСО3, (3)
при этом СаСО3 будет выпадать в осадок.
Возможны также условия, когда содержание в воде свободной углекислоты совпадает с равновесной — в этом случае вода считается стабильной.
В [2] отмечается, что часть свободной углекислоты, находящейся в равновесии с бикарбонатами (то есть гидрокарбонатами), имеет название «равновесной» и не вступает в химические реакции.
Таким образом, углекислый газ, согласно уравнению (1), «назначен» ответственным за показатель стабильности воды. Хотя такую же важную роль в уравнении (1) могут играть и НСО3–, и СО32–. НСО3– точно так же, в зависимости от концентрации, можно разделить на «равновесный» и «агрессивный» гидрокарбонат-ион, при котором образуется хорошо растворимый гидрокарбонат кальция.
СО32– можно рассматривать «равновесный» и «избыточный» — когда начинается активное образование СаСО3 и его выпадение в осадок. Также не вполне понятно, с какими веществами в природных водах углекислый газ вообще может вступать в химические реакции (помимо участия в углекислотном равновесии).
Следует отметить, что в уравнении (1) вовсе не присутствует такой компонент, как ион Н+, хотя сам индекс стабильности Ланжелье и определяется как разность рН исходной воды и рН той же воды, насыщенной карбонатом кальция (рНs). Здесь логика рассуждений в каком-то смысле распадается — непонятно, каким образом содержание углекислоты (свободной, агрессивной, равновесной — неважно) связано с активной реакцией воды рН, если в уравнении (1) не участвует Н+? Да и само понятие «углекислота» скорее затрудняет понимание вопроса, так как не всегда ясно, что имеется в виду: молекулярная H2CO3, растворённый углекислый газ, гидрокарбонаты или карбонаты.
Таким образом, уравнение (1), связывающее различные формы угольной кислоты, является неполным. В полном виде оно записывается как:
H2CO3 ↔ H2O + CO2 ↔ H+ + HCO3– ↔ 2 H+ + CO32–. (4)
Только такая запись позволяет понять, как стабильность воды зависит от щёлочности и рН.
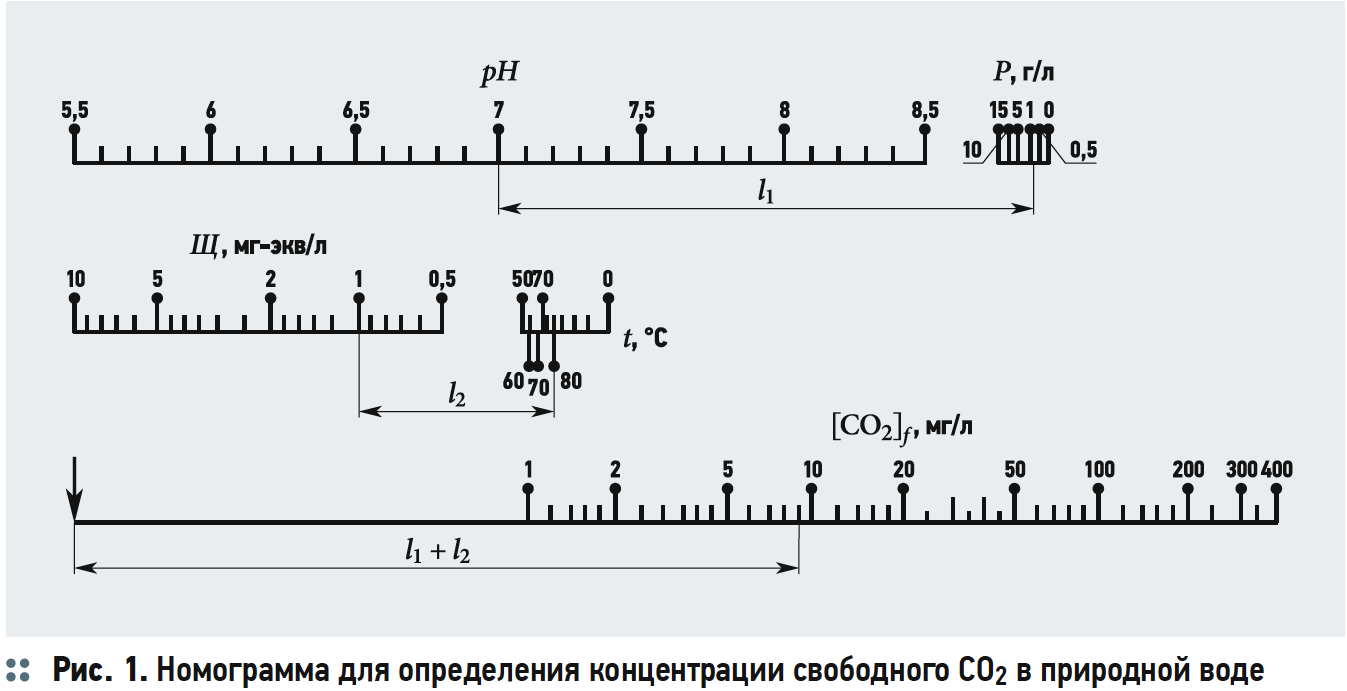
Содержание свободной двуокиси углерода обычно определяется по номограммам (рис. 1 из [3]). Как видно из рис. 1, концентрацию [CO2] определяют в зависимости от щёлочности Щ, рН воды, температуры и общего солесодержания.
Рассчитать содержание углекислого газа в воде [CO2] можно и с помощью формул, основанных на теории буферных растворов Хендерсона-Хассельбаха (подробнее см. в работе [4]).
В частности, концентрацию [CO2] можно оценить исходя из зависимостей:
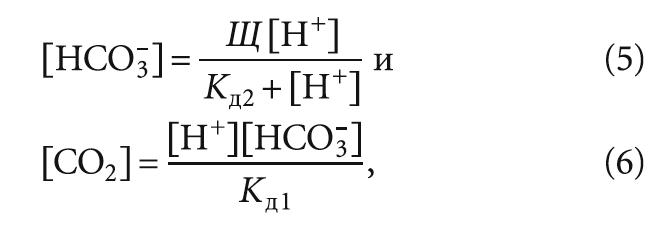
где Щ — щёлочность воды, моль/л; [HCO3–] — концентрация гидрокарбонат-ионов, моль/л; Кд1 и Кд2 — константы диссоциации (равновесия) для обеих частей реакции:
H2O + CO2 ↔ H+ + HCO3– и H+ + HCO3– ↔ 2 H+ + CO32– – Кд1 = 4,45 × 10–7,
Кд2 = 5,6 × 10–11 при 25 °C (надо отметить, что в справочниках по неорганической химии приводятся и иные значения Кд1 и Кд2); [H+] — концентрация ионов водорода, моль/л.
Формулы (5) и (6) учитывают все параметры, по которым определяется [CO2] согласно номограммам из [3], кроме солесодержания. Этот параметр для пресных вод (с минерализацией до 1 г/л) можно оценить с помощью коэффициента активности аниона fHCO3–, определяемого по формуле Дебая-Хюккеля:
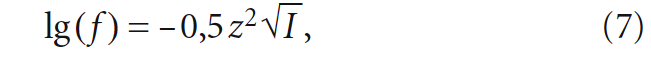
где z — заряд иона; I — ионная сила раствора, рассчитываемая по формуле:

где ci — молярные концентрации ионов, моль/л; zi — заряды ионов.
Для упрощения расчётов введено допущение, что вся минерализация (сухой остаток) представлена в виде хлорида натрия NaCl. Тогда при молярной массе NaCl, равной 58,44 г/моль:
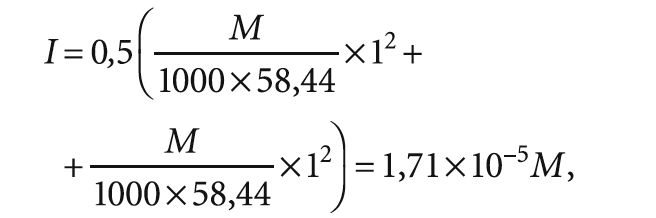
где М — минерализация воды, мг/л.
С учётом минерализации воды формула (6) примет вид:
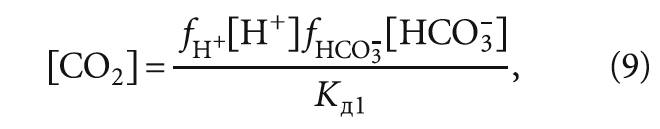
где [CO2]f — концентрация углекислого газа с учётом коэффициентов активности иона fH+ и fHCO3–; fH+ и fHCO3– — коэффициенты активности ионов водорода и гидрокарбонат-ионов.
Коэффициенты активности fH+ и fHCO3–, учитывая одинаковые по модулю заряды этих ионов, согласно формуле (7) будут равны:
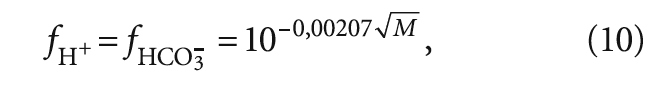
коэффициенты активности, соответственно, fCa2+ и fCO32–:
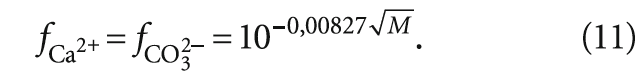
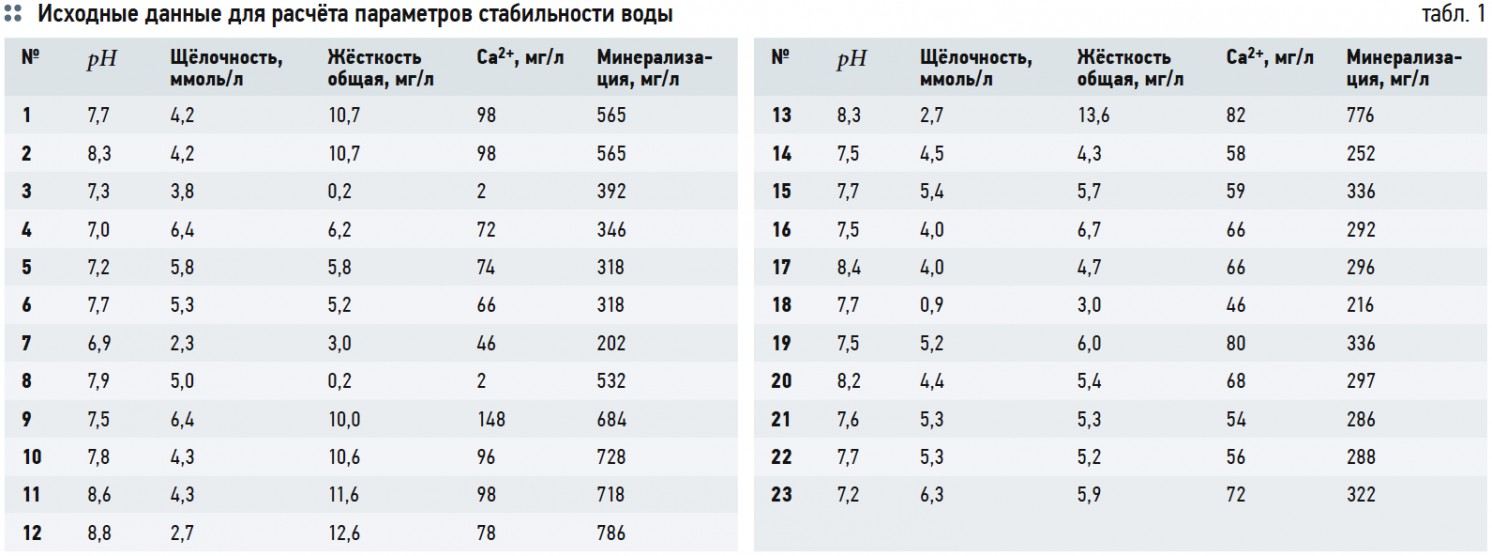
В табл. 1 представлены необходимые исходные данные для дальнейших расчётов (анализы воды из подземных источников — водозаборных скважин Московской области).
В табл. 2 представлены результаты расчётов концентрации ионов [HCO3–], ионной силы раствора I, коэффициентов активности ионов fH+ и fHCO3– и концентрации [CO2]f .
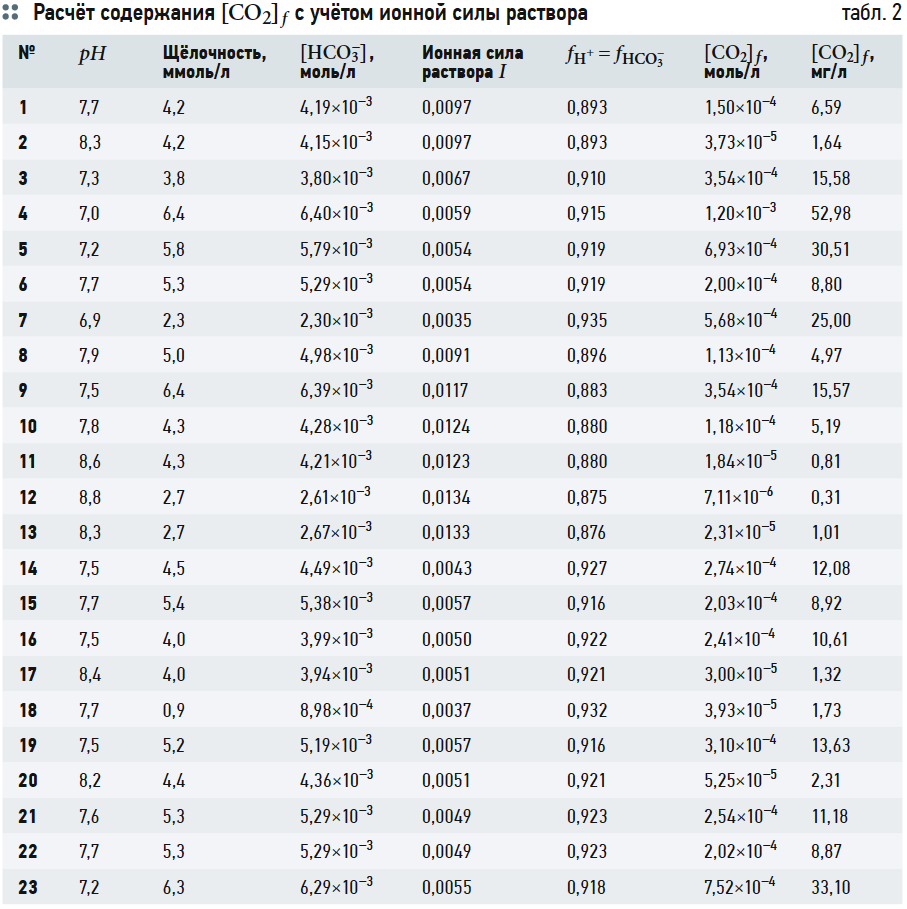
Следует отметить, что при расчётах по формуле (5), в принципе, следует также учитывать коэффициент активности иона fH+, однако структура выражения (5) такова, что fH+ на результаты расчётов почти не влияет.
Расчёты концентрации [CO2] согласно номограммам на рис. 1 из [3] представлены в табл. 3.
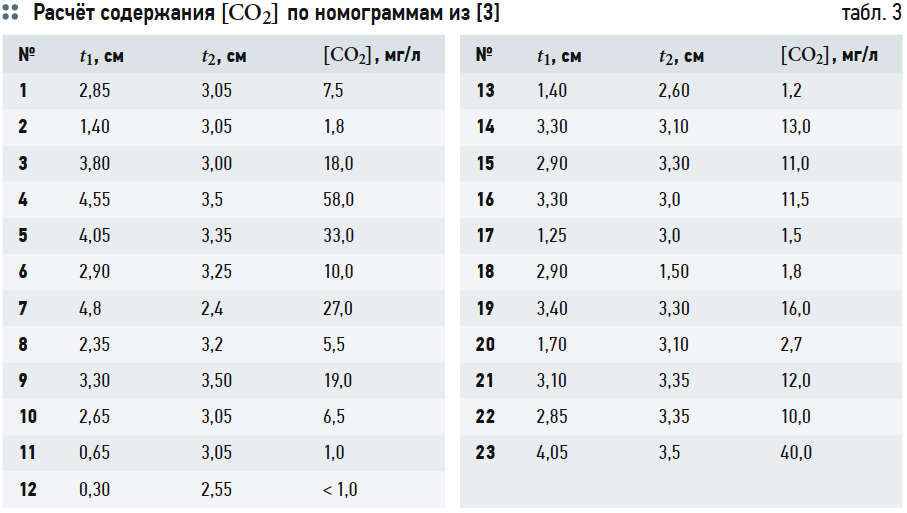
Хотя графические построения и вычисления по номограммам обладают известной субъективностью, но нетрудно заметить, что концентрации [CO2] («свободной углекислоты») в табл. 3 превышают аналогичные значения в табл. 2. Это несоответствие, как уже отмечалось, возникает из-за отождествления показателя щёлочности Щ и содержания гидрокарбонат-ионов [HCO3–], хотя на самом деле [HCO3–] всегда меньше Щ, пусть и на ничтожную величину.
Содержание свободной углекислоты (правильнее — растворённого углекислого газа) в мг/л определяют также по формуле (см. в [6]):
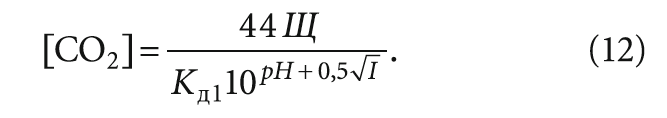
При внимательном рассмотрении формула (12) аналогична формуле (9) за исключением опять же использования щёлочности Щ вместо содержания гидрокарбонат-ионов [HCO3–].
Содержание равновесной углекислоты [CO2]p с учётом ионной силы раствора I, согласно [6], вычисляется по формуле:
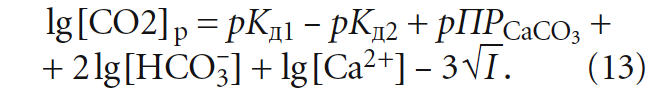
Учитывая, что [HCO3–] в рамках общепринятого подхода с трудом поддаётся расчёту, содержание [CO2]р в [6] предлагается оценивать с помощью не слишком наглядных номограмм (рис. 2 из [6]), хотя для этого существуют простые и удобные формулы (5) и (6). Авторы в [6] отмечают, что щёлочность Щ действительно равна сумме концентраций [HCO3–] и [CO32–], но при этом опять же выделяют некую «гидратную щёлочность» [OH–].
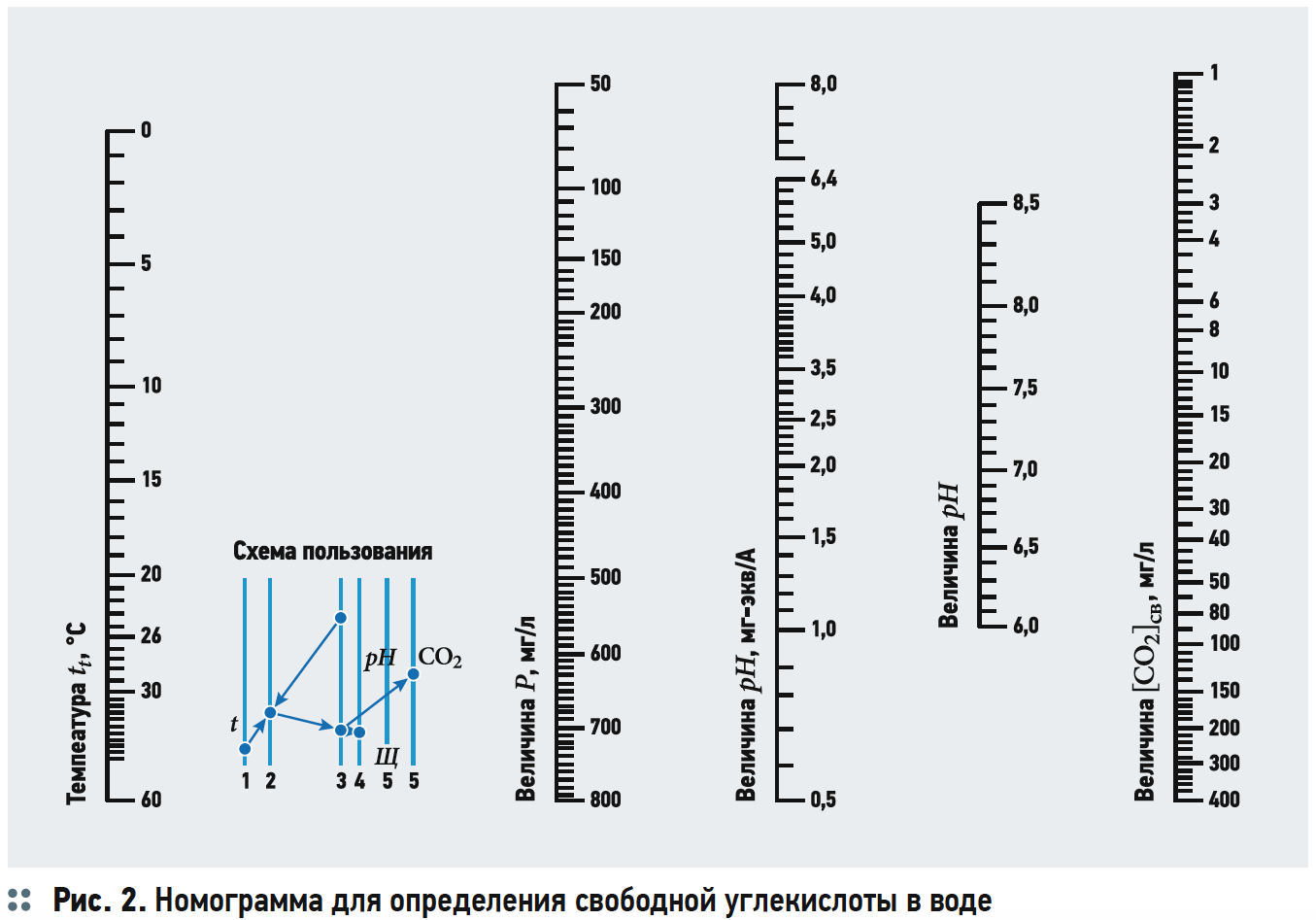
Не вдаваясь в подробный разбор формул (12) и (13), следует отметить, что оценка содержания углекислоты (углекислого газа) — свободной, равновесной, агрессивной — для расчётов стабильности воды скорее затрудняет понимание процесса, чем способствует решению технологических задач. Ведь в самом определении произведения растворимости применительно к карбонату кальция учитываются только концентрации [Ca2+], [CO32–] и коэффициенты активности fСa2+ и fCO32–, которые зависят от минерализации воды. А содержание [CO32–] определяется состоянием динамического равновесия, в котором находится углекислотный буферный раствор, которым и является подавляющее большинство природных вод, по крайней мере, подземных. В этом смысле расчёты растворенной углекислоты и её разновидностей представляются излишними. Правда, существует общепризнанная методика определения концентрации агрессивной углекислоты, описанная в сборнике [7].
Данная методика основана на определении разности щёлочности исходной воды и щёлочности после добавления в эту воду порошка мрамора (который имеет в своей основе CaCO3) с последующей выдержкой в течение шести часов или пяти суток в зависимости от способа проведения анализа. Затем эта разность пересчитывается на содержание углекислоты (растворенного углекислого газа).
Таким образом, анализ на агрессивную углекислоту носит скорее косвенный характер, так как фактически в ходе эксперимента стараются достичь образования насыщенного раствора карбоната кальция. В этом случае при избытке осадка карбоната кальция образуется насыщенный раствор, в котором произведение концентраций [Ca2+] и [CO32–] (с учётом коэффициентов активности) равно произведению растворимости ПРCaCO3 при данной температуре.
Чаще всего в литературе приводится значение произведения растворимости ПРCaCO3 при 25 °C, равное 4,8 × 10–9. Учитывая, что в формуле СaCO3 и у кальция, и у карбонат-иона индексы равны единице, то при полном насыщении исходной воды частицами карбоната кальция теоретически представляется верной формула:
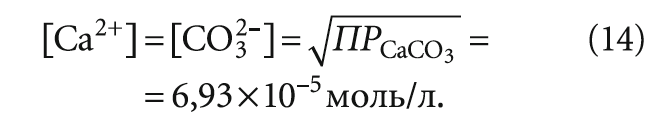
Следовательно, при определении индекса Ланжелье для насыщенной карбонатом кальция воды содержание карбонат-ионов [CO32–] следовало бы всегда принимать равным 6,93 × 10–5 моль/л, уточнив его только с учётом температуры и минерализации воды. Однако такое допущение представляется не вполне правомерным по двум причинам:
- во-первых, в подавляющем большинстве случаев в природных водах концентрации [Ca2+] и [CO32–] сильно различаются, и трудно предположить, что при добавлении твёрдого карбоната кальция они будут увеличиваться в одинаковой степени;
- во-вторых, выпадение осадка начинается, когда произведение концентраций [Ca2+] × [CO32–] достигнет ПРCaCO3 вне зависимости от соотношения [Ca2+] и [CO32–].
Во всяком случае, вопрос о предельных равновесных концентрациях при экспериментальном насыщении воды карбонатом кальция можно рассматривать отдельно и более подробно с точки зрения неорганической химии. Но даже если принять величину [Ca2+] = [CO32–] = 6,93 × 10–5 моль/л, то это в целом не помогает при расчёте Щs — щёлочности при предельном насыщении воды карбонатом кальция, необходимой для определения индекса Ланжелье.
Дело в том, что составляющие углекислотного буферного раствора — Н+, СО2, НСО3–, СО32– — находятся в состоянии динамического равновесия, и увеличение или снижение концентрации одного из этих составляющих, например, содержания [CO32–] до 6,93 × 10–5 моль/л, сразу вызовет перераспределение концентраций других составляющих, в том числе [Н+], то есть рН воды.
Строго говоря, любое воздействие на данную систему, будь то снижение [CO2] при аэрации, добавление кислот, щелочей, вызывающих изменение [Н+], гидролиз коагулянтов, обработка воды ионным обменом и другие технологические приёмы водоподготовки изменяют состояние углекислотного равновесия, которое влияет на химические свойства обрабатываемой воды. Эти изменения можно рассматривать на качественном уровне, но провести точную оценку, как изменится рН или щёлочность, при современном уровне развития теории буферных растворов, невозможно.
Таким образом, в известной формуле для расчёта «рН равновесного насыщения воды карбонатом кальция»:
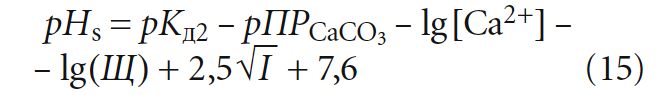
(хотя в [5] было показано, что более правильно использовать в ней коэффициент 7,3 вместо 7,6) значение щёлочности Щ (точнее — [HCO3–]) должно соответствовать состоянию равновесного насыщения, то есть Щs, оценить которое не представляется возможным.
С другой стороны, использование индекса стабильности Ланжелье J наглядно на качественном уровне показывает изменение состояния водного раствора при его насыщении карбонатом кальция.
Предположим, по результатам анализов и расчётов J´ = рН – рНs = 7,5 – 7,05 = +0,45, что указывает на склонность воды к выделению CaCO3. Это означает, что при насыщении воды карбонатом кальция некое количество карбонат-ионов CO32– вступит в реакцию с Ca2+ с образованием осадка. Снижение концентрации [CO32–] в свою очередь приведёт к изменению концентрации [НCO3–] (понижению или повышению — вопрос дискуссионный), но менее значительному, чем [CO3 2–], за счёт буферных свойств раствора.
Тогда, согласно уравнению
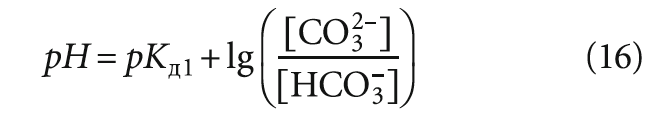
рН воды действительно снизится. Можно аналогичным образом описать и обратную ситуацию, когда J < 0. Далее будет показано, что на самом деле в индексе Ланжелье не заложены значения рНs или Щs, которые соответствовали бы предельному насыщению испытываемой воды карбонатом кальция. Оценим агрессивность воды или её способность к выделению осадка, сравнив [Ca2+] × [CO32–] (с учётом коэффициентов активности) со значением ПРCaCO3. Для стабильной воды будет верным равенство:
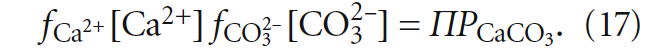
Обозначив получившийся показатель через J´ , выражение (17) можно записать иначе:
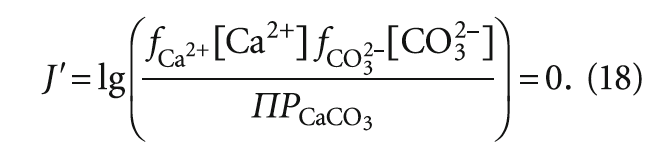
Тогда при значении J´ < 0 воду следует считать агрессивной, а, наоборот, при величине J´ > 0 — склонной к выделению карбоната кальция.
Значение [CO32–] [моль/л] можно оценить, исходя из уравнения углекислотного равновесия в воде (см. [4]):
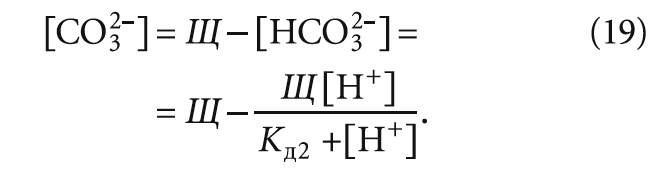
Расчётные величины согласно выражениям (11), (18), (19) сведены в табл. 4. В табл. 4 также представлены значения индекса Ланжелье, вычисленные по формуле из [5]:
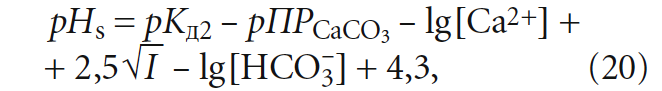
где [Ca2+] подставляется в мг/л, [HCO3 –] — моль/л, отсюда J = рН – рНs. (21)
Из табл. 4 видно, что значения J и J´ различаются незначительно. Более точно рассчитать J´ затруднительно из-за несовершенства метода оценки значений коэффициентов активности Ca2+ и CO32–, что связано с ограничениями, накладываемыми на теорию разбавленных сильных электролитов Дебая-Гюккеля (подробное рассмотрение данного вопроса в задачу автора не входит).
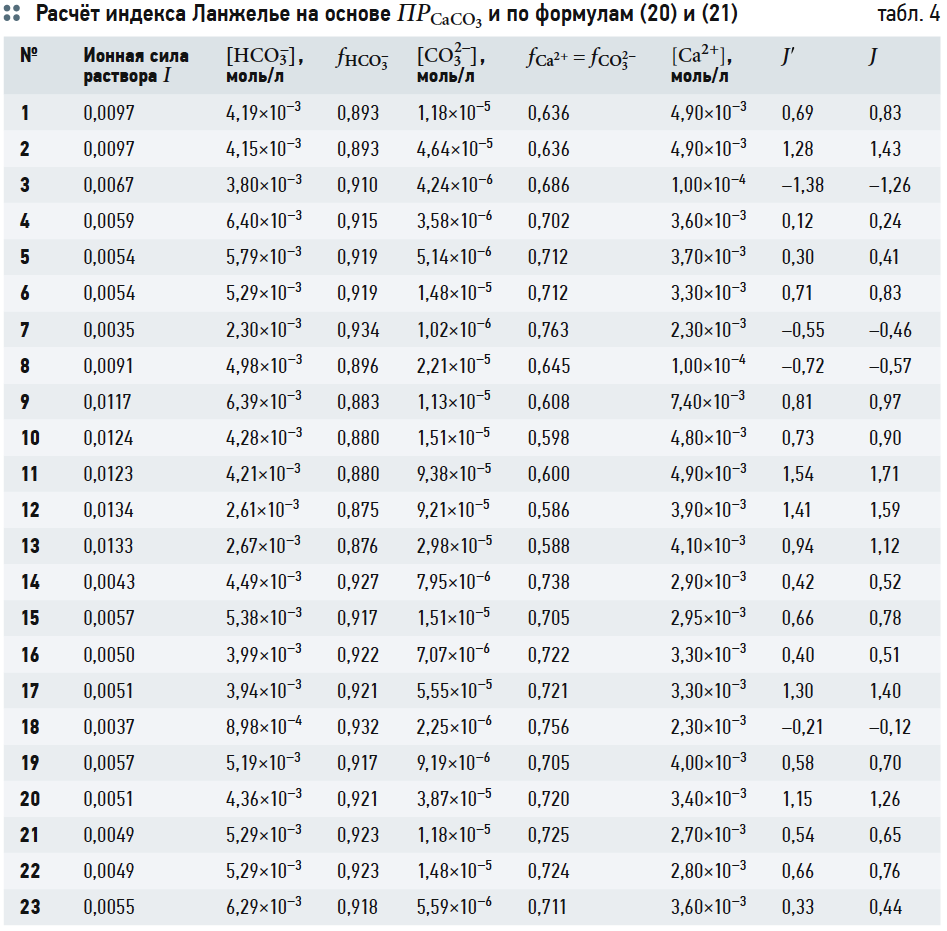
С другой стороны, незначительная разница между J и J´ приводит к следующему выводу: расчёт индекса Ланжелье J заключается не в сравнении исходных значений рН или щёлочности со значениями рНs и Щs, соответствующими состоянию полного насыщения воды карбонатом кальция, а в сравнении результата умножения концентраций [Ca2+] и [CO32–] (конечно, с учётом ионной силы раствора) с произведением растворимости ПРCaCO3.
Действительные значения рНs и Щs при нынешнем уровне развития химической науки расчёту не поддаются.
Выводы
1. Расчёты содержания растворенного углекислого газа («углекислоты») имеют лишь косвенное значение при определении индекса стабильности воды, так как агрессивность воды по отношению к бетону или склонность к выделению карбоната кальция определяются только концентрациями [Ca2+], [CO32–] и произведением растворимости ПРCaCO3, зависящим от температуры.
2. Влияние ионного состава воды на её стабильность оценивается через показатель ионной силы раствора I.
3. Показано, что при расчёте индекса стабильности Ланжелье сравниваются не исходные значения рН или щёлочности со значениями рНs или щёлочности Щs, соответствующие предельному насыщению этой воды карбонатом кальция, а произведение концентраций [Ca2+] и [CO32–] со значением ПРCaCO3 с учётом температуры и солесодержания.
4. Прогноз изменения концентраций всех составляющих углекислотного буферного раствора — [CO2], [HCO3–], [CO32–], а также рН воды — при каком-либо воздействии на систему при нынешнем уровне знаний о свойствах воды невозможен; одной из задач химической науки является совершенствование теории буферных растворов, которое позволило бы проводить подобные расчёты, что явилось бы технологическим прорывом в водоподготовке.

























