В качестве изотопологов в любой природной воде присутствуют так называемая «тяжелокислородная» (H217O и H218O), «тяжелая» (D216O) и тритиевая («сверхтяжелая») вода (Т216O), две последние из которых токсичны. Количество природных изотопологов воды, где атомы Н, D, T, 16O, 17O и 18O находятся в различных комбинациях, составляет 18, из которых девять комбинаций составляют нерадиоактивные и еще девять — радиоактивные тяжелые воды с участием трития. «Тяжелые» разновидности воды по своим физико-химическим свойствам и негативному воздействию на организм существенно отличаются от обычной воды. Поэтому нужно проводить изотопное фракционирование воды, то есть очищать воду от «тяжелых» изотопов.
Сейчас работы по улучшению изотопного качества воды ведутся во всех странах мира, включая Россию. Однако, существующие очистительные сооружения и технологии водоподготовки и водоочистки часто не справляются с поставленными задачами по очистке воды, и в нашей стране за последние годы разработаны различные перспективные методы и технологии фракционирования и изотопной очистки питьевой воды от «тяжелых» изотопов D, Т и 18O, подробно рассмотренные в этой статье.
Природная вода неоднородна по своему составу и представляет собой смесь изотопологов воды, то есть соединений с различным изотопным составом. В составе природной воды изотопы водоро-да (D) и кислорода (17O и 18O) образуют девять конфигураций изотопологов, шесть из которых образованы изотопологами дейтерия HD16O, HD17O, HD18O, D216O, D217O, D218O, и три конфигурации образованы изотопологами кислорода — Н216O, Н217O, Н218O [1].
Согласно теоретическим расчетам, в природе существуют 115 изотопных разновидностей воды, в которых ато-мы Н, D, T, 16O, 17O и 18O представлены в различных сочетаниях.
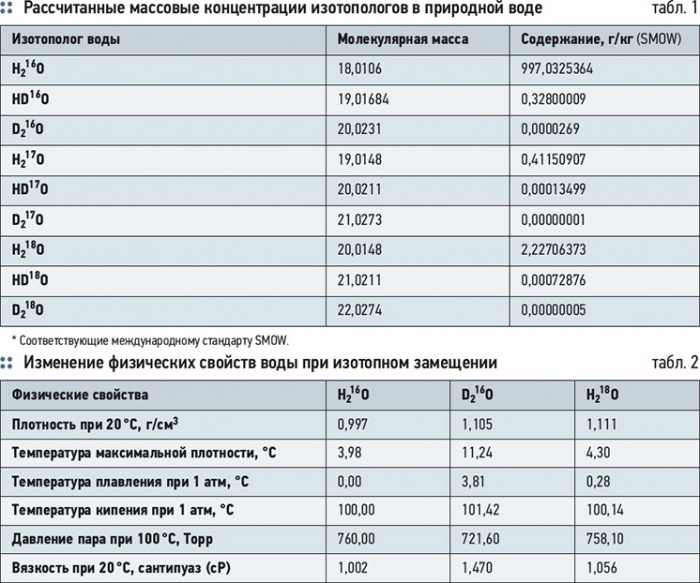
Если подсчитать все возможные различные соединения с общей формулой Н2О, то общее количество возможных «тяжелых вод» достигнет 48-ми. Из них 39 вариантов — радиоактивные, а стабильных вариантов всего девять — HD16O, HD17O, HD18O, D216O, D217O, D218O, Н216O, Н217O, Н218O. Таким образом, возможно существование молекул воды, в которых содержатся любые из трех водородных изотопов (Н, D и Т) и три изотопа кислорода (17O и 18O) в любом сочетании. Массовые концентрации изотопологов воды в природных водах, рассчитанные на основании данных определения их содержания методом ИК-спектроскопии, варьируют в пределах, зафиксированных в основных стандартах изотопного состава гидросферы Standard Marine Ordinary Water (SMOW) (табл. 1).
Как видно из табл. 1, в природной воде суммарная массовая концентрация тяжелых изотопологов D, T, 17O и 18O может достигать 2,97 г/кг, что является значительной величиной, сопоставимой с концентрацией минеральных солей в воде. В природных водах в 10 тыс. молекул, в среднем, содержится 9973 мо-лекул H215O, три молекулы HD16O, четыре молекулы H217O, 20 молекул H218O и около двух молекул D2O [2]. По международному стандарту SMOW абсолютное содержание D и 18O в океанической воде составляет: D SMOW/1H SMOW = (155,76±0,05)×10–6 или (155,76 ppm), 18O SMOW/16O SMOW = (2005,2±0,45)×10–6 или (2005 ppm) [3].
Для международного стандарта SLAP концентрации в воде составляют: для D D/H = 89×10–6(89 ppm), для 18O — 18O/16O = 1894 ×10–6(1894 ppm). Содержание самого легкого изотополога H216O в воде, соответствующей по изотопному составу SMOW, составляет величину 997,0325 г/кг (99,73 мол. %), а по изотопному составу SLAP — 997,3179 г/кг (99,76 мол. %).
В поверхностных водах имеет место отношение D/(H + D)= (1,32–1,51) ×10–4, а в прибрежной морской воде величина D/(H + D)= (1,55–1,56) ×10–4[4].

Способы извлечения «тяжелых» изотопов из воды: электролиз в сочетании с каталитическим изотопным обменом, колоночная ректификация, вакуумное замораживание холодного пара с оттаиванием
Для природных вод СНГ чаще всего характерны отрицательные отклонения от SMOW на (1,0–1,5) ×10–5, иногда до (6,0–6,7) ×10–5, но встречаются и положительные отклонения до 2,0 ×10-5.
Изотопологи воды различаются друг от друга по физическим свойствам (табл. 2). Разница атомных масс изотопов в природной воде велика, поэтому они способны сильно фракционировать в природных процессах: D/H — 100 %, 18O/16O — 12,5 %. Наиболее эффективно изотопы водорода и кислорода фракционируют в процессах испарения-конденсации и кристаллизации воды. Равновесное давление паров у изотопологов воды существенно различается. При этом, чем меньше масса молекулы воды, тем выше давление пара, поэтому пар, равновесный с водой, обогащен легкими изотопами водорода 1Н и кислорода 16О, что позволяет осуществлять изотопное фракционирование воды.
Изотопный состав воды не исчерпывается вышеперечисленными изотопами D, 17О и 18О: в ее состав также входит радиоактивный тритий (Т) с периодом полураспада 12,26 лет. Тритий образуется под действием жесткого радио- и нейтронного излучения в ядерных реакторах.

В земных условиях тритий зарождается в высоких слоях атмосферы, где протекают природные ядерные реакции. Он является одним из продуктов бомбардировки атомов азота нейтронами космического излучения. В небольших количествах тритиевая («сверхтяжелая») вода попадает на землю в составе осадков. Ежеминутно на каждый квадратный сантиметр земной поверхности попадают восемь-девять атомов трития.
Тритиевая вода распределена нерав-номерно: в материковых водоемах ее больше, чем в океанах, а в полярных океанских водах ее больше, чем в экваториальных. Во всей гидросфере Земли всего насчитывается около 20 кг Т2О. По своим физическим свойствам Т2О еще значительнее отличается от обычной: кипит при +104 °C, замерзает при +4,9 °C и имеет плотность 1,33 г/см3. Согласно расчетам, гравитационное поле Земли недостаточно сильно для удержания Н, и планета постепенно теряет легкий водород, который улетучивается быстрее тяжелых дейтерия и трития в результате диссоциации в межпланетное пространство. Поэтому в течение геологического времени должно происходить накопление дейтерия и трития в гидросфере и поверхностных водах [5]. В планетарном масштабе осуществляется испарительно-конденсационный процесс формирования протиевой воды Н216О и обогащения ею туч и облаков.
Химическое строение молекул изотопологов воды аналогично строению молекул Н2O с очень малым различием в значениях длин ковалентных связей и углов между ними. Однако, в случае с D2O молекулярная масса D2O (20,029 г/моль) на 11,1 % превышает массу Н2O (18,015 г/моль) — при том, что в случае с Т2О разница составляет 12,2 %.
Разница в молекулярных массах D2O и Н2O приводит к существенным различиям в физических, химических и биологических свойствах тяжелой воды. Тяжелая вода кипит при +101,44 °C, за-мерзает при +3,82 °C, имеет плотность при 20 °C — 1,105 г/см3, причем максимум плотности приходится не на 4 °C, как у обычной воды, а на 11,2 °C (1,106 г/см3).
Химические связи, сформированные атомами дейтерия, различаются по прочности и энергии от аналогичных связей с участием атомов водорода. Большая прочность связи D–O по сравнению с Н–О обуславливает различия в кинетике реакций тяжелой и обычной воды. По теории абсолютных скоростей разрыв С–H-связей может происходить быстрее, чем С–D-связей, подвижность иона D+ меньше, чем подвижность Н+, константа ионизации тяжелой воды меньше константы ионизации обычной воды [6]. Эти эффекты отражаются на кинетике химической связи и скорости химических реакций в D2O, протеолитические реакции и биохимические процессы в которой значительно замедлены.
Тяжелая вода слабее ионизирована, чем Н2O. Константа ионизации D2O при 298,15 K lg(Kн)= –14,71. Значения кон-станты ионизации [lg(Kн)= 78,06 при температуре 298,15 K], дипольного мо-мента (6,24 ×10–30Клм) и диамагнитной проницаемости (1,295 ×10–5Клм при 293,15 K) у D2O и Н2O почти не отличаются. Подвижность ионов D3O+ на 28,5 % ниже Н3O+, а ОD– — на 39,8 % ниже ОН–. Для других ионов различие подвижностей в НO и D2O составляет около 18 % [7]. Константы диссоциации слабых кислот и оснований Kd снижаются в D2O по сравнению с Н2O. Например, для уксусной кислоты константы диссоциации 0,51 ×10–5 в D2O и 1,7×10–5 в Н2O, для бензойной кислоты, соответственно, 1,96×10–5 и 6,09×10–5.
Растворимость, а также растворяющая способность D2O, как правило, ниже, чем у Н2O, хотя известны и обратные факты. Так, растворимость в D2O ниже, чем в Н2O, у сулемы при 0 °C на 42 %, K2Cr2O7 при 5 °C на 33,5 %, K2SO4 при 25 °C на 20,5 %. Растворимость в D2O в органических жидкостях по сравнению с Н2O снижается при 25 °C, например, в триэтиламине на 30 %, в СS2— на 21 %, в бензоле — на 17 %, в СНCl3— на 15 %, а в хлорбензоле — на 12 %.

Биологические эффекты легкой и тяжелой воды
Как показали исследования, биологические объекты очень чувствительно реагируют на изменение изотопного состава воды. При воздействии на них вод различного изотопного состава их реакция изменяется в зависимости от изотопного состава воды. В ряду стабильных изотопов 17О, 18О и D самые большие изотопные эффекты в разнице констант скоростей химических реакций с соотношением Kh/Kd= 7–10 наблюдаются в тяжелой воде для C–H/C–D, N–H/N–D и O–H/O–D связей [8]. Поэтому изотопные эффекты в биологических объектах в основном определяются дейтерием.
В смесях «тяжелой» воды с обычной водой с большой скоростью происходит изотопный обмен с образованием так называемой «полутяжелой» воды (НDO): Н2O + D2O = 2 НDO. Дейтерий при малом содержании присутствует в воде почти полностью в форме НDO, а при высоком — в форме D2O. Вышеназванные факторы, а также большая структурированность, плотность и вязкость D2O по сравнению с обычной водой приводят к изменению скоростей (замедлению) и специфичности ферментативных реакций в тяжелой воде [9]. Однако, надо отметить, что существуют и такие реакции, скорость которых в тяжелой воде выше, чем в Н2O. В основном это реакции, катализируемые ионами D+ или H+, или OD– и ОН–.
Когда клетка попадает в тяжелую воду, из нее не только удаляется протонированная вода за счет реакции обмена Н2О–D2О, но и происходит быстрый изотопный (H–D) обмен в гидроксильных (–ОН), сульфгидрильных (–SH) и аминогруппах (–NH2) всех органических соединений, включая белки, нуклеиновые кислоты, углеводы и липиды. Известно, что в этих условиях только ковалентная С–Н связь не подвергается изотопному обмену, и вследствие этого только соединения со связями типа С–D могут синтезироваться de novo[10]. В зависимости от того, какое положение занимает атом дейтерия в молекуле, различают первичные и вторичные изотопные эффекты дейтерия, опосредованные межмолекулярными взаимодействиями. В этом аспекте наиболее важными для структуры макромолекулы являются динамические короткоживущие водородные (дейтериевые) связи. Они формируются между соседними атомами дейтерия (водорода) и гетероатомами кислорода, углерода, азота, серы и «тяжелой» водой из окружающей среды и играют главную роль в поддержании пространственной структуры макромолекул и в межмолекулярных взаимодействиях.
Другое важное свойство определяется пространственной структурой «тяжелой» воды, имеющей тенденцию сближать гидрофобные группы макромолекул, чтобы минимизировать их эффект на водородную (дейтериевую) связь в присутствии молекул «тяжелой» воды. Поэтому структура макромолекул белков и нуклеиновых кислот в присутствии D2О стабилизируется [11].

Полученные нами экспериментальные данные свидетельствуют о том, что клетка реализует особые адаптивные механизмы, способствующие функциональной реорганизации работы жизненно-важных систем в «тяжелой» воде. Так, например, нормальному синтезу и функционированию в «тяжелой» воде таких важных соединений как нуклеиновые кислоты и белки способствует поддержание их структуры посредством формирования водородных (дейтериевых) связей в молекулах. Связи, сформированные атомами дейтерия, различаются по прочности и энергии от аналогичных водородных связей. Большая прочность связи D–O по сравнению с Н–О обуславливает различия в кинетике реакций тяжелой и обычной воды.
По теории абсолютных скоростей разрыв С–H-связей может происходить быстрее, чем С–D-связей, подвижность ионов D3O+ на 28,5 % ниже Н3O+, а ОD– — на 39,8 % ниже ОН–, константа ионизации «тяжелой» воды меньше константы ионизации обычной воды [12]. Эти эффекты отражаются на химической кинетике и скорости химических реакций в тяжелой воде. Протеолитические реакции и биохимические процессы в D2O значительно замедлены.
Фракционное разделение «легкой» и «тяжелой» воды осуществляется путем создания разряжения воздуха над поверхностью воды при данной температуре
Эффекты тяжелой воды определяются концентрациями дейтерия. В природных водах содержание дейтерия распределено неравномерно: от 0,02–0,03 мол. % для речной и морской воды, до 0,015 мол. % для воды из льда Антарктиды, наиболее «обедненной» по дейтерию природной воды с содержанием дейтерия в полтора раза меньшим, чем в морской воде. Талая снеговая и ледниковая воды в горах и некоторых других регионах Земли также содержат меньше тяжелой воды, чем обычная питьевая вода. В одной тонне речной воды содержится 150–200 г тяжелой воды. Согласно расчетам, в организм человека на протяжении всей жизни поступает около восьмидесяти тонн воды, содержащей в своем составе 10–12 кг дейтерия и значительные количества коррелирующих с ним изотопов водо-рода и кислорода — D и 18О. Такое значительное количество тяжелых изотопов водорода и кислорода в составе питьевой воды способно к наступлению половой зрелости человека повредить его гены и привести к развитию некоторых онкологических заболеваний, а также инициировать старение организма.
«Тяжелая» вода высокой концентрации токсична для организма; химические реакции в ее среде проходят медленнее по сравнению с обычной водой, водородные связи с участием дейтерия несколько сильнее обычных [13]. Клетки животных способны выдерживать до 25–30 % D2O, растений — до 60 % D2O, а клетки простейших микроорганизмов способны жить на 90 % D2O (рис. 1).
Попадая в организм, «тяжелая» вода может стать причиной нарушений обмена веществ, работы почек, гормональной регуляции и снижения иммунитета. При больших концентрациях «тяжелой» воды (дейтерия) в организме подавляются ферментативные реакции, клеточный рост, углеводный обмен и синтез нуклеиновых кислот. Особенно страдают системы, наиболее чувствительные к замене Н+ на D+, которые используют высокие скорости образования и разрыва водородных связей.
Такими системами являются аппарат биосинтеза макромолекул и дыхательная цепь. Последний факт позволяет рассматривать биологическое воздействие «тяжелой» воды как комплексное воздействие одновременно на функциональное состояние большого числа систем: метаболизм, биосинтетические процессы, транспорт веществ, структуру и функции макромолекул. В результате это приводит к гибели клеток в D2O.

Тем не менее, «тяжелая» вода играет значительную роль в различных биологических процессах. Важным обстоятельством является то, что углеродные связи с участием дейтерия более прочны и стабильны, чем углеродные связи с участием водорода. Изотопные эффекты, энергия связи, константа диссоциации, подвижность, длина связи для пары «водород–тритий» также различны. А это означает, что в первичной воде на Земле самоорганизующиеся дейтерированные структуры смогли сохраниться дольше во времени. Есть основания полагать, что в ту эпоху существовал процесс структурирования в водной тяжеловодородной среде органических молекул, поскольку структурирующее свойства и стабилизирующее воздействие «тяжелой» воды на химические связи более выражены, чем у обычной воды [14]
Систематическое изучение воздействия «тяжелой» воды на клетки животных, растений и бактерий в нашей стране начато сравнительно недавно [15]. Различные исследователи установили, что «тяжелая» вода действует отрицательно на жизненные функции организмов; это происходит даже при использовании обычной природной воды с повышенным содержанием тяжелой воды. Эксперименты проводились клетках животных, растений и простейших. Подопытных мышей поили водой, третья часть которой была заменена водой состава HDO. Через несколько дней у животных начиналось расстройство обмена веществ, впоследствии разрушались почки. При увеличении концентрации дейтерия в потребляемой воде животные погибали [16]. И, наоборот, уменьшение концентрации дейтерия в питьевой воде стимулировало биологические процессы и обмен веществ. Это свидетельствует о том, что дейтерий тормозит, а протий способствует обмену веществ в биологических объектах. «Тяжелая» вода также способна вызывать физиологические, морфологические, цитологические и генетические изменения в клетке [17]. Возможное повреждение генофонда организма тяжелыми изотопами водорода в составе воды может иметь тяжелые последствия для человечества, если оно не перейдет на употребление легкой воды, обедненной дейтерием и другими тяжелыми изотопами — 18О и Т.
Тяжелая вода также способна вызывать физиологические, морфологические, цитологические и генетические изменения в клетке
Поэтому в начале XXI века появилось мнение о полном исключении тяжелых изотопов дейтерия D, кислорода 18О и трития Т из потребляемой питьевой воды. Эта задача достигается различными физико-химическими методами — изотопным обменом в присутствии палладия или платины, многоступенчатым электролизом воды в сочетании с каталитическим изотопным обменом между водой и водородом; низкотемпературной ректификацией жидкого водорода с последующим сжиганием Н2 с кислородом; вакуумной заморозкой воды с последующим оттаиванием, вакуумной ректификацией и др. Для получения особо чистой H216O проводят очень тонкую, многостадийную очистку природной воды совокупностью вышеуказанных методов или синтезируют воду из исходных газообразных элементов 1H2 и 16O, которые предварительно очищают от изотопных примесей. Такую воду применяют в экспериментах и процессах, требующих исключительной чистоты химических реактивов.
По данным Г.Д. Бердышева, даже неглубокая (на 5–10 %) очистка воды от «тяжелых» изотопов (D и 18О) способна значительно улучшить ее качества и придать воде полезные очистительные свойства [18]. В Институте медико-биологических проблем РАН был проведен 240-суточный эксперимент по изучению изменений изотопного состава биогенных химических элементов в организме человека, в ходе которого установлено, что в условиях сильного стресса и неблагоприятных внешних воздействий организм в первую очередь выводит тяжелые изотопы D и 18О за счет реакций изотопного (H/D, 16О/18О) обмена) [19]. Для повышения жизненных сил организма в условиях неблагоприятных вешних воздействий целесообразно потреблять свободную от «тяжелых» изотопов легкую воду. В Японии, США и некоторых других странах «легкую» воду используют для профилактики опухолевых забо-леваний. При этом снижение риска онкологических заболеваний при регулярном употреблении «легкой» воды связывают с очисткой организма от «тяжелых» изотопов, в первую очередь от дейтерия.
Эксперименты на животных и растениях показали, что при потребление воды с пониженным на 25–30 % содержанием дейтерия свиньи, крысы и мыши дают более крупное и многочисленное потомство, содержание домашней птицы с шестисуточного возраста и до половозрелости на бездейтериевой воде приводит к ускоренному развитию половых органов (по размерам и весу) и усилению процесса сперматогенеза, яйценоскость кур повышается почти вдвое, пшеница созревает раньше и дает более высокий урожай [20].
Кроме того, легкая вода с пониженным содержанием дейтерия задерживает появление первых узелков метастаз на месте перевивки рака шейки матки, оказывает иммуномодулирующее и радиопротекторное действие. Потребление легкой воды онкологическими больными во время или после сеансов лучевой терапии позволяет восстановить состав крови и снять приступы тошноты после сеансов. По данным Г. Шомлаи, результаты клинических испытаний, проведенных в 1994–2001 годах в Венгрии, показали, что уровень выживаемости больных, употреблявших легкую воду, в сочетании с традиционными методами лечения или после них значительно выше, чем у больных, использовавших только химио- или лучевую терапию.
Исследования «легкой» воды в Московском научно-исследовательском онкологическом институте имени П.А. Герцена и в НИИ Канцерогенеза Российского онкологического научного центра имени Н.Н. Блохина РАМН совместно с Институтом медико-биологических проблем [21] подтвердили ингибирующие эффекты «легкой» воды на процесс роста различных опухолей и установили, что в среде с более низким, чем природное, содержанием дейтерия деление опухолевых клеток аденокарциномы молочных желез MCF-7 начинается с задержкой на 5–10 ч. У 60 % мышей с подавленным иммунитетом и пересаженными грудными человеческими опухолями MDA и MCF-7 прием «легкой» воды (30 ppm) вызывал регрессию опухолей. У группы мышей с пересаженной человеческой опухолью простаты РС-3 прием «легкой» воды (90 ppm) увеличивал уровень выживаемости на 40 %, при этом соотношение числа делящихся клеток к погибшим в опухолях животных опытной группы составляло 1,5:3, а контрольной группе — 3,6:1.
>>> Также читайте по теме Бор – пути очистки питьевой воды в журнале СОК 2013 №5

























