Электроактивированные растворы воды — католиты и анолиты можно использовать в сельском хозяйстве, для повышения урожайности растений, в животноводстве, медицине, для обеззараживания воды и в бытовых целях. Электрохимическая обработка воды включает несколько электрохимических процессов, связанных с переносом в постоянном электрическом поле электронов, ионов и других частиц (электролиз, электрофорез, электрофлотация, электрокоагуляция), основным из которых является электролиз воды. Настоящая статья знакомит читателя с основными процессами, лежащими в основе электролиза воды.

Введение
Явление электрохимической активации воды (ЭХАВ) — совокупность электрохимического и электрофизического воздействия на воду в двойном электрическом слое (ДЭС) электродов (анода и катода) при неравновесном переносе заряда через ДЭС электронами и в условиях интенсивного диспергирования в жидкости образующихся газообразных продуктов электрохимических реакций. В процессе ЭХАВ происходят четыре основных процесса:
— электролитическое разложение воды (электролиз) за счет окислительно-восстановительных реакций на электродах, обусловленных внешним постоянным электрическим полем;
— электрофорез — движение в электрическом поле положительно заряженных частиц и ионов к катоду, а отрицательно заряженных частиц и ионов к аноду;
— электрофлотация — образование газовых флоккул и агрегатов, состоящих из мелкодисперсных пузырьков газа (водорода на катоде и кислорода на аноде) и грубодисперсных примесей воды;
— электрокоагуляция — образование коллоидных агрегатов частиц осаждаемой дисперсной фазы за счет процесса анодного растворения металла и образования катионов металлов Al3+, Fe2+, Fe3+ под воздействием постоянного электрического поля.
В результате обработки воды постоянным электрическим током, при потенциалах равных или превышающих потенциал разложения воды (1,25 В) вода переходит в метастабильное состояние, характеризующееся аномальными значениями активности электронов и других физико-химических параметров (рН, Eh, ОВП, электропроводность) [1]. Прохождение постоянного электрического тока через объем воды сопровождается электрохимическими процессами, в результате которых происходят окислительно-восстановительные реакции, приводящие к деструкции (разрушению) водных загрязнений, коагуляции коллоидов, флокуляции грубодисперсных примесей и их последующей флотации.
Явление электрохимической активации воды — это совокупность электрохимического и электрофизического воздействия на воду в двойном электрическом слое электродов при неравновесном переносе заряда.
Электрохимическая обработка применяется для осветления и обесцвечивания природных вод, их умягчения, очистки от тяжелых металлов (Cu, Co, Cd, Pb, Hg), хлора, фтора и их производных, для очистки сточных вод, содержащих нефтепродукты, органические и хлорорганические соединения, красители, СПАВ, фенол [2]. Достоинствами электрохимической очистки воды является то, что она позволяет корректировать значения водородного показателя рН и окислительно-восстановительного потенциала Еh, от которого зависит возможность протекания различных химических процессов в воде; повышает ферментивную активность активного ила в аэротенках; уменьшает удельное сопротивление и улучшает условия коагуляции и седиментации органических осадков [3].
В 1985 году ЭХАВ была официально признана в качестве нового класса физико-химических явлений. Поручением правительства РФ от 15.01.98 No ВЧ-П1201044 даны рекомендации министерствам и ведомствам использовать данную технологию в медицине, сельском хозяйстве, промышленности.
Электролиз воды
Основной стадией электрохимической обработки воды является электролиз воды. При пропускании постоянного электрического тока через воду, поступление в воду электронов у катода, также как и удаление электронов из воды у анода, сопровождается серией окислительно-восстановительных реакций на поверхности катода и анода. В результате образуются новые вещества, изменяется система межмолекулярных взаимодействий, состав воды, в том числе структура воды [4]. Типовая установка для электрохимической обработки воды состоит из блока подготовки воды 1, электролизера 2, блока обработки воды после электрохимической очистки 3 (рис. 1).
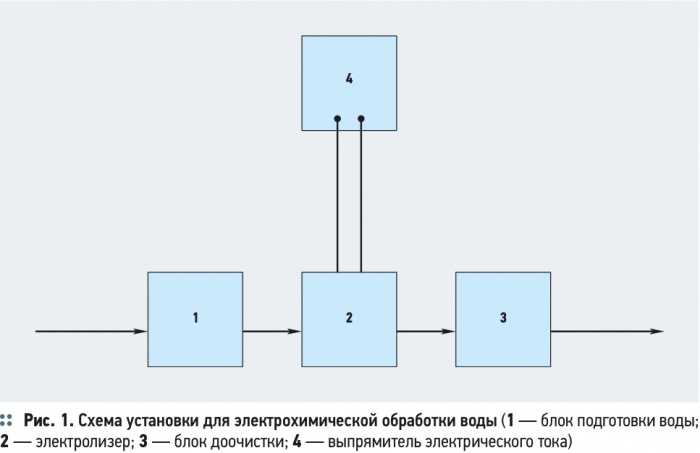
В некоторых установках электрохимической обработки воды предусматривается предварительная механическая очистка воды, уменьшающая опасность засорения электролитической ячейки грубодисперсными примесями с большим гидравлическим сопротивлением. Блок для механической очистки воды необходим, если в результате электрохимической обработки вода насыщается грубодисперсными примесями, например, хлопьями гидрооксидов металлов (Al(OH)3, Fe(OH)3, Mg(OH)2) после электрокоагуляции. Основным элементом установки является — электролизер, состоящий из одной или нескольких электролизных ячеек (рис. 2).
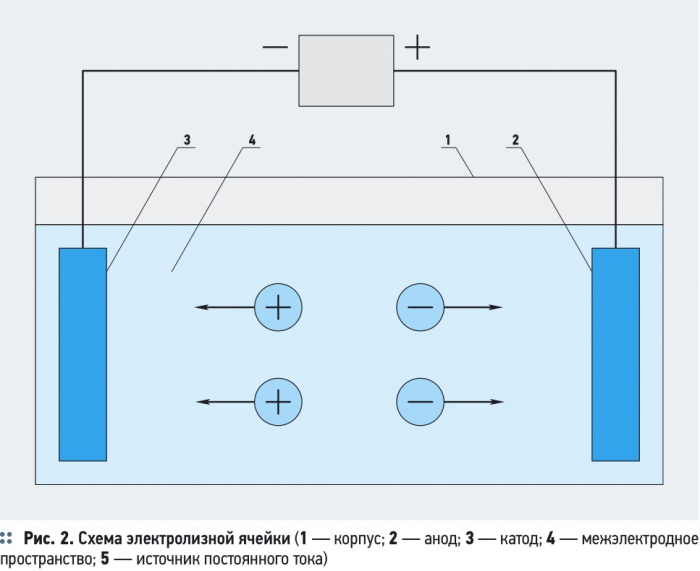
Электролизная ячейка образована двумя электродами — положительно заряженным анодом и отрицательно заряженным катодом, присоединенными к разным полюсам источника постоянного тока. Межэлектродное пространство заполнено водой, являющейся электролитом, способным проводить электрический ток. В результате работы прибора происходит перенос электрических зарядов через слой воды — электрофорез, то есть миграция полярных частиц, носителей зарядов — ионов, к электродам, имеющим противоположный знак.
При пропускании постоянного электрического тока через воду, поступление в воду электронов у катода, также как и удаление электронов из воды у анода, сопровождается серией окислительно-восстановительных реакций на поверхности катода и анода.
При этом к аноду перемещаются отрицательно заряженные — анионы, а к катоду — положительно заряженные катионы. У электродов заряженные ионы теряют заряд, деполяризуются, превращаясь в продукты распада. Кроме заряженных ионов в электрофорезе участвуют полярные частицы различной дисперсности, включая и грубодисперсные (эмульгированные частицы, пузырьки газов и др.), но главную роль в переносе электрохимических зарядов играют обладающие наибольшей подвижностью заряженные ионы. К полярным частицам относятся полярные частицы из числа водных примесей и молекулы воды, что объясняется их особой структурой.
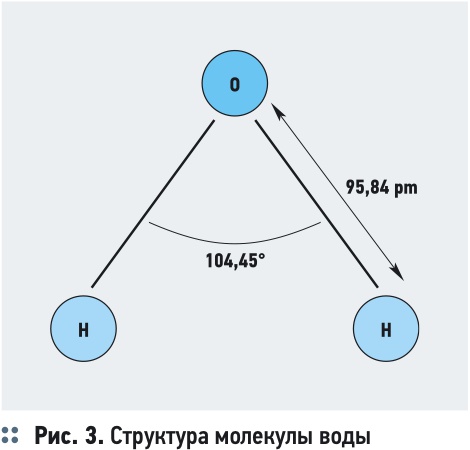
Входящий в состав молекулы воды центральный атом кислорода, имеющий большую электроотрицательность, чем атомы водорода, оттягивает на себя электроны, придавая молекуле асимметричность. В результате происходит перераспределение электронной плотности: молекула воды поляризуется, принимая свойства электрического диполя, имеющего дипольный момент 1,85 Д (Дебаи), с положительным и отрицательным зарядами на полюсах (рис. 3).
Продуктами электродных реакций являются обезвреженные водные примеси, газообразные водород и кислород, образующиеся при электролитическом разрушении молекул воды, катионы металлов (Al3+, Fe2+, Fe3+) в случае применения металлических анодов из алюминия и стали, молекулярный хлор и др. При этом на катоде генерируется газообразный водород, а на аноде — кислород. В составе воды содержится некоторое количество иона гидроксония Н3О+, деполяризующегося на поверхности катода с образованием атомарного водорода Н:
Н3О+ + е- → Н + Н2О.
В щелочной среде Н3О+ отсутствует, но происходит разрушение молекул воды, сопровождающееся образованием атомарного водорода Н— и гидроксидиона ОН-:
Н2О + е- → Н + ОН-.
Реакционно-способные атомы водорода адсорбируются на поверхностях катодов и после рекомбинации образуют молекулярный водород Н2, выделяющийся из воды в газообразном виде:
Н + Н → Н2.
Одновременно у анодов происходит выделение атомарного кислорода. В кислой среде этот процесс сопровождается разрушением молекул воды:
2Н2О - 4е- →O2 +4Н+.
В щелочной среде источником образования кислорода всегда служат гидроксид-ионы ОН-, перемещающиеся под действием электрофореза на электродах, от катода к аноду:
4 ОН- → О2 + 2 Н2О + 4 е-.
Нормальные окислительно-восстановительные потенциалы этих реакций: +1,23 и +0,403 В, соответственно, но процесс протекает в условиях некоторого
перенапряжения. Электролизную ячейку можно рассматривать в качестве генератора вышеназванных продуктов, некоторые из которых, вступая в химическое взаимодействие между собой и с водными загрязнениями в межэлектродном пространстве, обеспечивают дополнительную химическую очистку воды (электрофлотация, электрокоагуляция) [5]. Эти вторичные процессы происходят не на поверхности электродов, а в объеме воды. Поэтому в отличие от электродных процессов они обозначаются объемными. Они инициируются повышением температуры воды в процессе электролиза и увеличением значения рН при катодном разрушении молекул воды.
Различают катодное и анодное окисление. При катодном окислении молекулы органических веществ, сорбируясь на катодах, акцептируют свободные электроны, восстанавливаются, трансформируясь в соединения, не являющиеся загрязнениями. В одних случаях процесс восстановления проходит в один этап:
R + H+ + е- → RH , где R — органическое соединение; RH — гидратированная форма соединения, не являющаяся загрязнением.
В других случаях катодное восстановление проходит в два этапа: на первом этапе (I) органическая молекула превращается в анион, на втором (II) — анион гидратируется, взаимодействуя с протоном воды:
R + е- → R-, (I) R- + H+ → RH. (II)
Различают катодное и анодное окисление. При катодном окислении молекулы органических веществ, сорбируясь на катодах, акцептируют свободные электроны, восстанавливаются.
Катоды из материалов, требующих высокого перенапряжения (свинец, кадмий), позволяют при большой затрате электроэнергии разрушать органические молекулы и генерировать реакционно-способные свободные радикалы — частицы, имеющие на внешних орбитах атомов или молекул свободные неспаренные электроны (Cl*, O*, ОН*, НО*2 и др.). Последнее обстоятельство придает свободным радикалам свойство реакционно-способности, то есть способости вступать в химические реакции с водными примесями и разрушать их.
Далее, при анодном окислении молекулы органического вещества, адсорбируясь на аноде, отдают электроны с одновременной или с предшествующей гидратацией:
RH → R + H+ + е- .
Анодное окисление органических соединений часто приводит к образованию свободных радикалов, дальнейшие превращения которых определяются их реакционной способностью. Процессы анодного окисления многостадийны и протекают с образованием промежуточных продуктов. Анодное окисление снижает химическую устойчивость органических соединений и облегчает их последующую деструкцию в ходе объемных процессов [6].
В объемных окислительных процессах особую роль играют продукты электролиза воды — кислород (O2), перекись водорода (Н2О2) и кислородосодержащие соединения хлора (HClO). В процессе электролиза образуется чрезвычайно реакционно-способное соединение — Н2О2, формирование молекул которой происходит за счет гидроксил-радикалов (ОН*), являющихся продуктами разрядки на аноде гидроксил-ионов (OH—):
2OH- → 2OH* → Н2О2 + 2е-, где ОН* — гидроксил-радикал.
Реакции взаимодействия органических веществ с окислителями протекают в течение определенного промежутка времени, длительность которого зависит от величины окислительно-восстановительного потенциала элемента и концентрации реагирующих веществ. По мере очистки и снижения концентрации загрязняющего вещества процесс окисления уменьшается.
Скорость процесса окисления при электрохимической обработке зависит от температуры обрабатываемой воды и от рН. В процессе окисления органических соединений образуются промежуточные продукты, отличающиеся от исходного как устойчивостью к дальнейшим превращениям, так и показателями токсичности.
Источником получения активного хлора и его кислородосодержащих соединений, генерируемых в электролизере, являются хлориды, находящиеся в обрабатываемой воде, и хлористый натрий (NaCl), который вводится в обрабатываемую воду перед электролизом. В результате анодного окисления анионов Cl— генерируется газообразный хлор Cl2. В зависимости от рН воды он либо гидролизуется с образованием хлорноватистой кислоты HOCl, либо образует гипохлорит-ионы ClO-. Равновесие реакции зависит от значения рН.
При рН =
ClO- + A = C + Cl, где А — окисляемое вещество; С — продукт окисления.
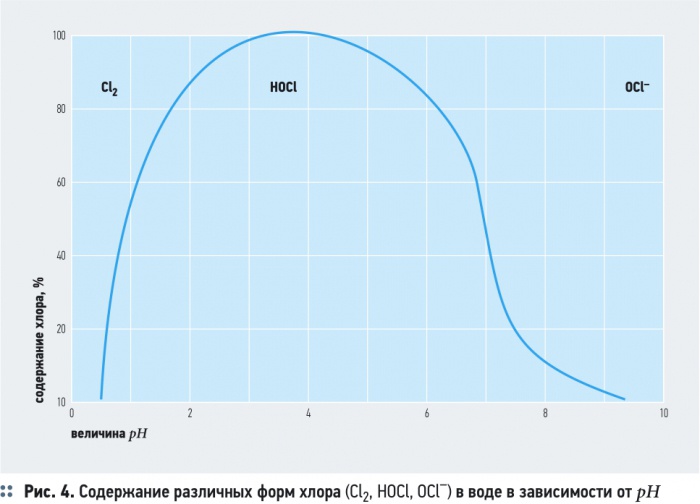
Электрохимическое окисление органических соединений гипохлоритионом (ClO-) сопровождается увеличением окислительно-восстановительного потенциала Eh, что указывает на преобладание окислительных процессов [7]. Рост Eh зависит от отношения концентрации активного хлора в межэлектродном пространстве к содержанию органических примесей в воде. По мере очистки и уменьшения количества загрязнений это соотношение возрастает, что приводит к увеличению Eh, но потом этот показатель стабилизируется.
Количество вещества, прореагировавшего на электродах при пропускании постоянного электрического тока по закону Фарадея, прямо пропорционально силе тока и времени обработки:
G = AIcurτ, (1)
где А — электрохимический эквивалент элемента, г/(А⋅ч); Icur — сила тока, А; τ — время обработки, ч. Электрохимический эквивалент элемента определяется по формуле:
A = M / 26,8z , (2)
где М — атомная масса элемента, г; z — его валентность. Значения электрохимических эквивалентов некоторых элементов приведены в табл. 1.
Фактическое количество вещества, генерируемого при электролизе, меньше теоретического, рассчитанного по формуле (1), так как часть электроэнергии затрачивается на нагревание воды и электродов. Поэтому при расчетах учитывается коэффициент использования тока η < 1, величина которого определяется экспериментально.
При электродных процессах происходит обмен заряженных частицами и ионами между электродом и электролитом — водой. Для этого в установившихся равновесных условиях необходимо создание электрического потенциала, минимальная величина которого зависит от вида окислительно-восстановительной реакции и от температуры воды при 25 °C (табл. 2).
К основным параметрам электролиза воды относятся сила и плотность тока, напряжение в пределах электродной ячейки, а так же скорость и продолжительность пребывания воды между электродами.
Напряжения, генерируемые в электродной ячейке, должны быть достаточными для возникновения окислительно-восстановительных реакций на электродах. Значение напряжения зависит от ионного состава воды, наличия в воде примесей, например СПАВ, плотности тока (его сила отнесенная к единице площади электрода), материала электродов и др. При прочих равных условиях задача выбора электродного материала заключается в том, чтобы для прохождения окислительно-восстановительных реакций на электродах, требуемое напряжение было минимальным, поскольку это позволяет снизить затраты электрической энергии.
Некоторые окислительно-восстановительные реакции являются конкурирующими — протекают одновременно и взаимно тормозят друг друга. Их протекание возможно регулировать за счет изменения напряжения в электролитической ячейке. Так, нормальный потенциал реакции образования молекулярного кислорода составляет +0,401 В или +1,23 В; при увеличении напряжения до +1,36 В (нормальный потенциал реакции образования молекулярного хлора) на аноде будет выделяться только кислород, а при дальнейшем увеличении потенциала — одновременно и кислород, и хлор, причем выделение хлора будет происходить с недостаточной интенсивностью. При напряжении около
Расчет основных параметров процесса электролиза воды
К основным параметрам электролиза воды относятся сила и плотность тока, напряжение в пределах электродной ячейки, а так же скорость и продолжительность пребывания воды в межэлектродном пространстве.
Сила тока Icur — величина, определяемая в зависимости от требуемой производительности по генерируемому продукту [А], определяется по формуле:
Icur = G / Atη , (3)
Эта формула получена путем преобразования формулы (1) с учетом коэффициента использования тока η. Плотность тока — это его сила, отнесенная к единице площади электрода [А/м2], например, анода, определяется из следующего выражения:
iан = Icur / Fан , (4)
где Fан — площадь анода, м2. Плотность тока оказывает самое определяющее влияние на процесс электролиза: то есть с увеличением плотности тока интенсифицируются электродные процессы и уменьшается площадь поверхности электродов, но одновременно возрастают напряжение в электролизной ячейке и, как следствие, всю энергоемкость процесса [8]. Повышенное увеличение плотности тока интенсифицирует выделение электролизных газов, приводящее к бурлению и диспергированию нерастворимых продуктов электрообработки воды.
При увеличении плотности тока также усиливается пассивация электродов, заключающаяся в блокировке поступающих электронов поверхностными отложениями анода и катода, что увеличивает электрические сопротивления в электродных ячейках и тормозит окислительно-восстановительные реакции, протекающие на электродах.
Аноды пассивируются в результате образования на их поверхностях тонких оксидных пленок, в результате сорбции на анодах кислорода и других компонентов, которые, в свою очередь, сорбируют частицы водных примесей. На катодах образуются, в основном, карбонатные отложения, особенно в случае обработки воды с повышенной жесткостью. В силу этих причин плотность тока при электролизе воды должна назначаться минимальной по условиям устойчивого протекания необходимых окислительно-восстановительных реакций в ходе технологического процесса.
Продолжительность пребывания воды в межэлектродном пространстве электролизера ограничивается временем, необходимым для генерации нужного количества продуктов электролиза.
Напряжение в электродной ячейке [В] определяется по формуле:
Vя = iан ΔKг / χR , (5)
где iан — плотность тока, А/м2; D — расстояние между электродами (ширина межэлектродного канала), м; χR — удельная электропроводность воды,1/(Ом⋅м); Кг — коэффициент газонаполнения межэлектродного пространства, обычно принимается Кг =
Формула (5) не учитывает электрических сопротивлений электрода в связи с их низкими значениями, но при пассивации эти сопротивления оказываются значительными. Ширина межэлектродного канала принимается минимальной
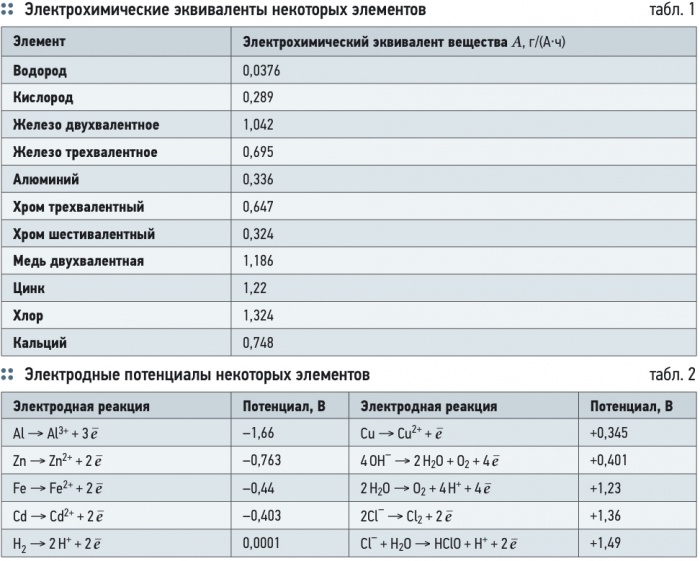
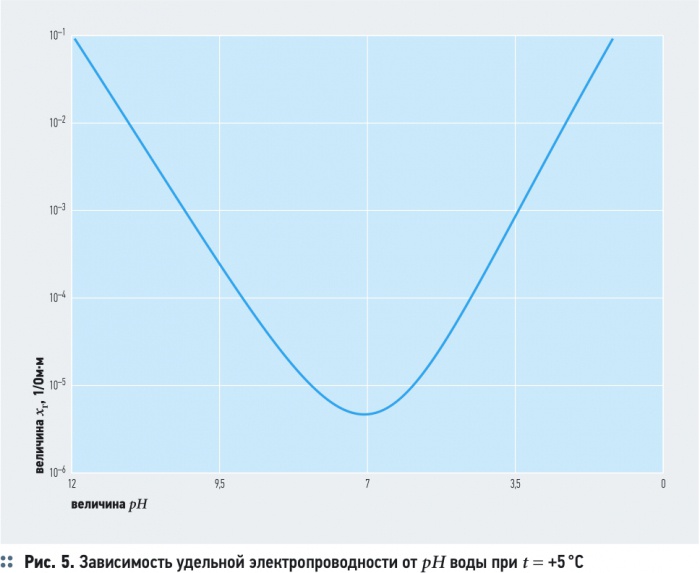
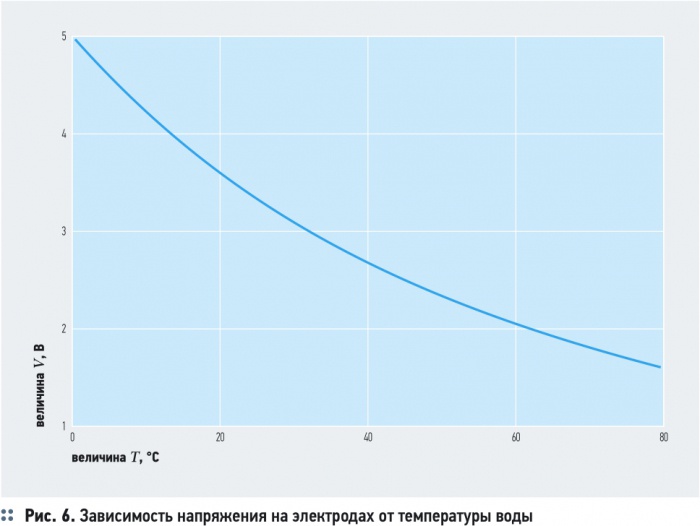
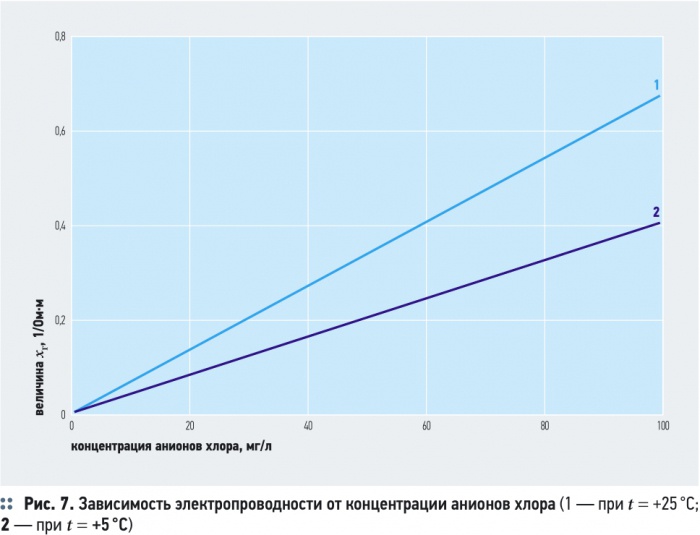
Удельная электропроводность воды χR зависит от ряда факторов, среди которых наиболее существенны температура, рН, ионный состав и концентрация ионов (рис. 5). С увеличением температуры электропроводность χR увеличивается, а напряжение уменьшается (рис. 6). Минимальное значение электропроводности соответствует значению рН = 7. Кроме этого, в процессе электролиза происходит повышение температуры и рН воды. Если рН > 7, то можно ожидать уменьшения удельной электропроводности воды χR, а при значениях рН < 7 удельная электропроводность воды χR, наоборот, возрастает (рис. 5).
Удельная электропроводность природных вод средней минерализации составляет
Потребляемая мощность [Вт] электролизера определяется по следующей зависимости:
Nпотр = ηэIcurVэ, (6)
где ηэ — коэффициент полезного действия электролизера, обычно принимается ηэ =
Продолжительность пребывания воды в межэлектродном пространстве электролизера ограничивается временем, необходимым для генерации нужного количества продуктов электролиза, а также продолжительностью соответствующих объемных реакций, и определяется экспериментально.
Скорость движения воды в межэлектродном пространстве задается с учетом условий выноса из электролизера продуктов электролиза и других примесей; кроме того, от скорости движения воды зависит турбулентное перемешивание, что влияет на ход объемных реакций. Как и продолжительность пребывания воды, скорость воды выбирается на основании экспериментальных данных.
Продолжение следует.
1. Бахир В.М., Лиакумович А.Г., Кирпичников П.А., Спектор Л.Е., Мамаджанов У.Д. Физическая природа явлений активации веществ // Изв. АН УзССР. Сер. техн. наук., No1/1983.
2. Кульский Л.А. Очистка воды электрокоагуляцией / Л.А. Кульский, П.П. Строкач, В.А. Слипченко и др. — Киев: Будiвельник, 1978.
3. Липовецкий Я.М. Электрохимические способы очистки питьевых и сточных вод / Я.М. Липовецкий, Я.Д. Раппопорт — М.: ЦБНТИ Минжилкомхоза РСФСР, 1985.
4. Кирпичников П.А., Бахир В.М., Гамер П.У., Добреньков Г.А., Лиакумович А.Г., Фридман Б.С., Агаджанян С.И. О природе электрохимической активации сред // Докл. АН СССР, No3/1986, Т. 286.
5. Бахир В.М., Задорожний Ю.Г. Электрохимические реакторы РПЭ. — М.: «Гиперокс», 1991.
6. Яковлев С.В. Технология электрохимической очистки воды / С.В. Яковлев, И.Г. Краснобородько, В.М. Рогов. — Л.: Л.О. Стройиздат, 1987.
7. Бахир В.М. Современные технические электрохимические системы для обеззараживания, очистки и активирования воды. — М.: ВНИИИМТ, 1999.
8. Бахир В.М., Задорожний Ю.Г., Леонов Б.И., Паничева С.А., Прилуцкий В.И. Электрохимическая активация: очистка воды и получение полезных растворов. — М.: ВНИИИМТ, 2001.
9. Кульский Л.А. Справочник по свойствам, методам анализа и очистке воды. Ч. 1 / Л.А. Кульский, И.Т. Гороновский, А.М. Когановский и др. — Киев: Наукова думка, 1980.
10. Медриш Г.Л. Обеззараживание природных и сточных вод с использованием электролиза / Г.Л. Медриш, А.А. Тайшева, Д.Л. Басин. — М.: Стройиздат, 1982.
11. Воловник Г.И. Теоретические основы очистки воды / Г.И. Воловник, Л.Д. Терехов. Ч. 1. — Хабаровск: Изд-во ДВГУПС, 2000.
12. Бахир В.М. Электрохимическая активация. Ч. 2. — М.: ВНИИИ мед. техники, 1992.
13. Бабцова Н.Ф., Комаров И.Ф. Опыт использования установки СТЭЛ в хирургическом отделении / II Межд. симп. «Электр. активация», Ч. 1. — М., 1999.
14. Леонов Б.И., Прилуцкий В.И., Бахир В.М. Физикохимические аспекты биологического действия электрохимически активированной воды. — М.: ВНИИИМТ, 1999.
15. Бахир В.М. Теоретические аспекты электрохимической активации / II Межд. симп. «Электр. активация». Ч. 1. — М., 1999.
16. Торопков В.В., Альтшуль Э.Б., Торопкова Е.В. Токсикологическая характеристика препарата католит / III Межд. симп. «Электр. активация». — М., 2001.
17. Леонов Б.И., Бахир В.М., Вторенко В.И. Электрохимическая активация в практической медицине / II Межд. симп. «Электрохимическая активация», Ч. 1. — М., 1999.
18. Торопков В.В. Альтшуль Э.Б., Пересыпкин О.И. Фармакологическая эффективность действия анолитов АН и АНК на слизистые оболочки ротовой полости / II Межд. симп. «Электр. активация» // Тез., докл. и сообщ. Ч. 1. — М., 1999.
19. Прилуцкий В.И., Бахир В.М. Электрохимически активированная вода: аномальные свойства, механизм биологического действия. — М.: ВНИИИМТ, 1997.
20. Паничева С.А. Новые технологии дезинфекции и стерилизации сложных изделий медицинского назначения. — М.: ВНИИИМТ, 1998.

























