Удельный расход соли для регенерации катионита является важнейшим параметром для качественной работы установки умягчения воды. Если данный показатель слишком высок, то часть соли будет неэффективно расходоваться на регенерацию катионита. Может возникнуть перерасход соли и, соответственно, избыток высокоминерализованных сточных вод. Если данный показатель слишком низкий, то установка умягчения будет регенерироваться неполноценно, что приведёт к уменьшению фильтроцикла и ухудшению качества умягчённой воды.
Какой же удельный расход соли необходимо обеспечить для эффективной регенерации катионита?
Известно, что сила взаимодействия катионов с катионитом зависит от заряда катиона и его гидратированного радиуса. Чем меньше радиус гидратированного иона и больше его заряд, тем сильнее он взаимодействует с катионитом. Иными словами, существует ряд:
Li < Na < NH4 < K < Mg2+ < Ca2+.
В данном ряду кальций имеет наибольшее «сцепление» с катионитом, затем магний и т. д. Кальций, как и магний, имеет заряд «+2″, но при этом кальций обладает меньшим радиусом гидратированного иона (табл. 1). То есть кальцию проще «войти» на катионит по сравнению с магнием, то же самое — для натрия и калия. Каждый из этих ионов одновалентный, но при этом радиус гидратированного иона калия меньше, чем натрия. Поэтому кальций будет иметь преимущество при обмене с катионитом при наличии двухвалентного магния и других одновалентных ионов.
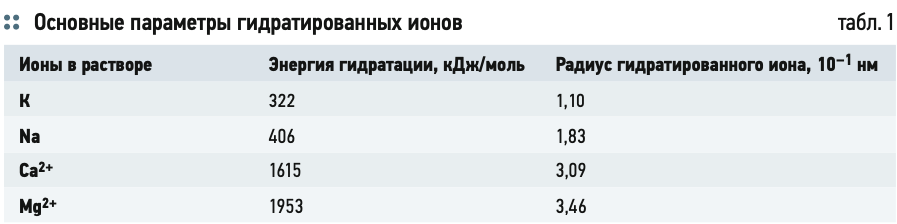
Фактически, чем меньше энергии ион тратит на взаимосвязь с водой (энергия гидратации), тем проще ему перейти на катионит из воды по сравнению с другим ионом. Но данное правило работает только для сравнения ионов, имеющих одинаковый заряд.
Для наглядного представления об обмене ионами в растворе с катионитом давайте рассмотрим три схемы на рис. 1.
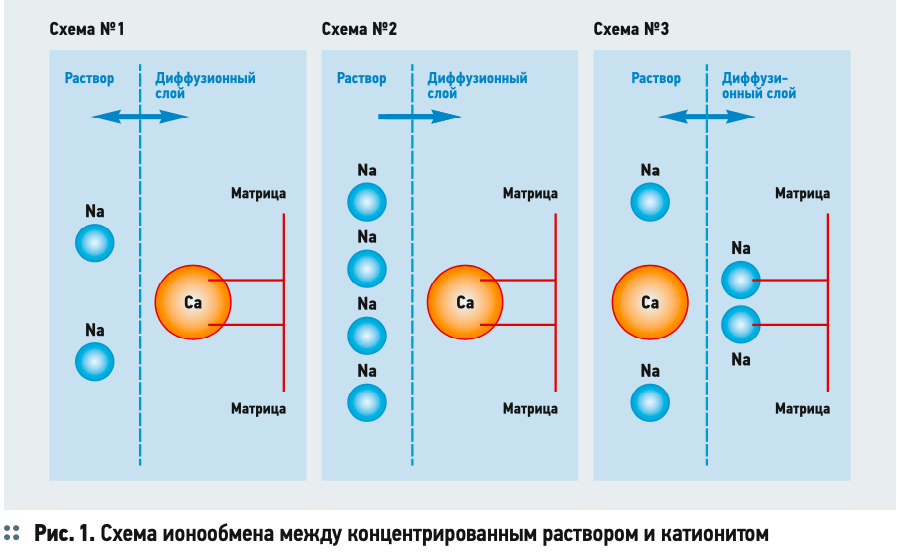
На этих схемах представлен катионит в виде нерастворимой матрицы и диффузионный слой, в котором происходит обмен между ионами катионита и раствора. Предположим, что на матрице катионита существует только две ионообменные связи. На схеме №1 обе связи катионита удерживают один катион двухвалентного кальция. При этом в растворе присутствует только два катиона натрия. В данном случае в системе взаимодействия будет наблюдаться равновесие. Кальций держится двумя связями за матрицу катионита. При этом на те же две связи катионита претендуют два натрия. Если оба натрия перейдут на катионит, то они «вытолкнут» кальций в раствор. Но тогда кальций, который имеет преимущество перед натрием, не имея конкуренции перед другими катионами натрия в растворе (их в растворе больше нет), просто обменяется обратно с натрием катионита.

Переходя к концентрациям отдельных катионов, можно сказать, что в данном случае 1 г-экв кальция находится в равновесии с 1 г-экв натрия. Или один моль кальция находится в равновесии с двумя молями натрия. При этом на катионите находится кальций. Действительно, в соответствии с указанным выше рядом один моль кальция имеет преимущество в ионном обмене перед одним молем натрия.
Очевидно, что для того, чтобы «выбить» кальций с катионита и заместить его на натрий, натрия в растворе будет требоваться минимум в два раза больше, чем кальция в эквивалентных количествах. На схеме №2 показано, что, если в растворе будет четыре катиона натрия, процесс ионообмена сдвинется в сторону замещения одного катиона кальция катионита на два катиона натрия раствора. В результате ионного обмена будет получено равновесное состояние, изображённое на схеме №3. Два катиона натрия будут на катионите, но при этом в растворе также останется два катиона натрия. Данные катионы будут «конкурировать» с катионом кальция, обеспечивая полученное равновесие. Один катион кальций в соответствии с зарядом имеет преимущество перед двумя катионами натрия, но, поскольку на катионите уже есть катионы натрия, обмен приведёт к увеличению концентрации катионов натрия в растворе в два раза (приведёт заново к схеме №2), и они заново обменяются с кальцием, выведя его в раствор. Поэтому при такой концентрации натрия будет достигнуто равновесие, когда кальций уже будет находиться в растворе, а на матрице катионита будет натрий. Если в растворе будет три катиона натрия, то, если двухвалентный кальций перейдёт в раствор, он будет конкурировать только с одним одновалентным катионом натрия. Соответственно, кальций вернётся на катионит, а в растворе будет три катиона натрия. Только четыре катиона натрия «заставят» выйти кальций из диффузионного слоя катионита.
Получаем, что для качественной регенерации катионита (полного замещения поглощённых ионов жёсткости из исходной воды на ионы натрия регенерационного раствора) количество натрия в регенерационном растворе должно быть в два раза больше, чем количество катионов жёсткости на катионите, взятое в грамм-эквивалентах. Это теоретически необходимый минимум натрия.
Причём анализируя данную схему становится понятно, что при таком количестве натрия неважно, подаётся ли регенерационный раствор снизу катионита или сверху. В любом случае все ионы жёсткости будут замещены.
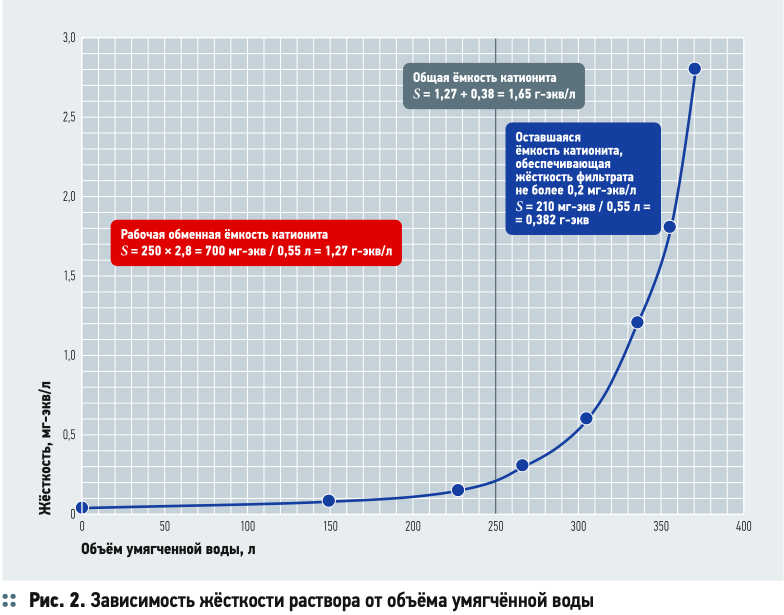
Рассмотрим пример. Фильтр умягчения заполнен катионитом в Na-форме. Объём катионита — 0,55 л. Жёсткость исходной воды равна 2,8 мг-экв/л. В результате проведённого опыта по получению умягчённой воды было установлено, что общая обменная ёмкость 1 л катионита составила 1,65 г-экв/л (рис. 2), а рабочая ёмкость — 1,27 г-экв/л. В рамках этой рабочей ёмкости катионита удалось получить воду с требуемой жёсткостью (менее 0,2 мг-экв/л).
Вопрос, сколько NaCl потребуется для регенерации рабочей обменной ёмкости катионита?
В соответствии с рассмотренной выше схемой обмена двухвалентных катионов на одновалентные можно сказать, что для регенерации вывода с катионита (регенерации) 1,27 г-экв кальция и магния потребуется теоретически необходимый минимум в 1,27×2,0 = 2,54 г-экв натрия. Примем коэффициент эффективности регенерации (обеспечения полноты регенерации) равным 1,1.
Коэффициент эффективности регенерации обеспечивает небольшой избыток натрия в регенерационном растворе — немного больший, чем необходимый теоретический минимум. Это позволяет обеспечить полноценную регенерацию.
Получаем, что для регенерации 1 л катионита, содержащего 1,27 г-экв катионов жёсткости, потребуется 2,54×1,1 = 2,8 г-экв натрия или 2,8×58,5 = 163,8 г/л поваренной соли (58,5 г/моль — молярная масса NaCl). В данном случае удельный расход соли для регенерации 1 л катионита составил 163,8 г/л.
Если требуется провести регенерацию общей ёмкости катионита (например, в случае, когда была пропущена очередная регенерация катионита), то удельный расход соли будет равен 1,65×2,0×1,1 = 3,63 г-экв/л или 3,63×58,5 = 212 г/л.
Общая обменная ёмкость современных сильнокислотных катионитов в среднем составляет около 1,9 г-экв/л. В этом случае для полной регенерации смолы потребуется 1,9×2,0×1,1×58,5 = 244 г. соли на 1 л катионита.
Общая обменная ёмкость современных слабокислотных катионитов в среднем составляет около 3,8–4,2 г-экв/л. Тогда удельный расход соли для полной регенерации такого катионита составит 4,2×2,0×1,1×58,5 = 540 г/л.
Необходимо обозначить важный момент. Ионообмен на катионите работает по представленной схеме только при концентрациях водного раствора более 20 г/л. Полное соответствие с представленной схемой достигается при концентрации водных растворов от 70 г/л. Если в воде наблюдается малая концентрация ионов, то двухвалентные катионы имеют значительно большее преимущество в ионообмене с катионитом по сравнению с одновалентными, и схема на рис. 2 работает с большей погрешностью. То есть данную схему можно использовать только для концентрированных регенерационных растворов.
По моему мнению, данное обстоятельство можно объяснить тем, что при малых концентрациях ионов (умягчение пресной воды) для катионов определяющее значение имеет и заряд, и подвижность.
При малых концентрациях более подвижному натрию, имеющему меньший радиус гидратированного иона, сложно конкурировать с ненамного менее подвижным, но двухвалентным кальцием при данной малой концентрации. В концентрированных растворах ионы значительно теряют в подвижности, и на первый план выходит валентности ионов, а влияние подвижности начинает уменьшаться, и ионообмен начинает происходить по схеме на рис. 1.
Этим можно объяснить, почему в процессе Na-катионирования пресной воды из неё практически полностью можно удалить ионы жёсткости. При этом увеличение общей концентрации ионов в исходной, не умягчённой воде приводит к увеличению концентрации двухвалентных ионов жёсткости в умягчённой воде даже в начале фильтроцикла на полностью восстановленном катионите.
Важно отметить, что для получения глубоко умягчённой воды необходимо, чтобы в нижней части катионита всегда был только натрий. Это условие для исходной пресной воды обеспечит получение умягчённой воды практически с нулевой жёсткостью.

На рис. 2 можно видеть, что нижняя «инертная» часть катионита должна содержать только натрий. Если там появится кальций, предположим, от неправильно установленного фильтроцикла, то этот кальций будет обмениваться с натрием умягчённой воды в самой нижней части фильтра, и умягчённая вода будет иметь повышенную жёсткость. Для рассматриваемого на рис. 2 примера необходимая «инертная» натриевая часть катионита составила (1,27/1,65)×100% = 23% от общего объёма катионита. Чем больше общая концентрация ионов в исходной воде, тем больше должна быть инертная часть катионита. Исходя из этого условия рабочая обменная ёмкость всегда меньше общей обменной ёмкости катионита.
В итоге, зная количество прошедшей за фильтроцикл воды, исходную и полученную жёсткости воды, можно довольно просто определить оптимальный удельный расход соли для полноценной регенерации катионита. Удельный расход соли будет равен количеству поглощённых 1 л катионита ионов жёсткости за фильтроцикл (взятых в грамм-эквивалентах), умноженному на 2,0 и на коэффициент эффективности регенерации.
Для случая, когда требуется получить глубоко умягчённую воду, значением жёсткости умягчённой воды можно пренебречь. Тогда значение удельного расхода соли [г соли на 1 л катионита] для регенерации 1 л катионита будет равно:
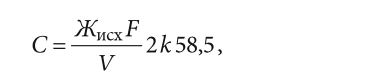
где Жисх — жёсткость исходной воды, мг-экв/л; F — объём фильтроцикла, м³; V — объём катионита в фильтре, л; k — коэффициент эффективности регенерации, k = 1,1–1,2.
Для автоматизированных систем умягчения необходимо учитывать сезонные колебания значения жёсткости исходной воды поверхностных источников водоснабжения. Например, для реки Волги в районе города Саратова жёсткость воды колеблется от 2,5 мг-экв/л в августе — сентябре до 4,5 мг-экв/л в марте — апреле.
В таком случае при режимной наладке автоматизированных установок умягчения устанавливать единое значение удельного расхода соли возможно только для максимального значения жёсткости. Иначе в определённый период года установка просто не обеспечит необходимое умягчение воды. Но это приводит к значительным перерасходам соли в тёплый период года. Это обстоятельство необходимо учитывать при производстве наладочных работ.

























