Жидкостной экстракцией в системе «жидкость-жидкость» называется процесс избирательного извлечения компонентов жидкой (чаще всего водно-органической) фазы при помощи селективного растворителя, в котором хорошо растворяются извлекаемые компоненты и мало растворяются остальные компоненты. Он широко применяется в химической, нефтеперерабатывающей, фармацевтической, пищевой и других отраслях промышленности, например, для извлечения ароматических углеводородов и масел из нефтепродуктов.
Общие положения
Экстракция в системе «жидкость-жидкость» — массообменный процесс извлечения растворённого вещества или веществ из жидкости с помощью с помощью избирательных (селективных) растворителей (экстрагентов) [1]. Жидкостная экстракция предполагает перенос одного или более растворимых веществ, содержащихся в растворе, в другую несмешиваемую жидкую фазу (экстрагент). Экстрагент, обогащённый растворимыми веществами, называется экстрактом. Остаток исходного раствора без растворимых веществ называется рафинатом.
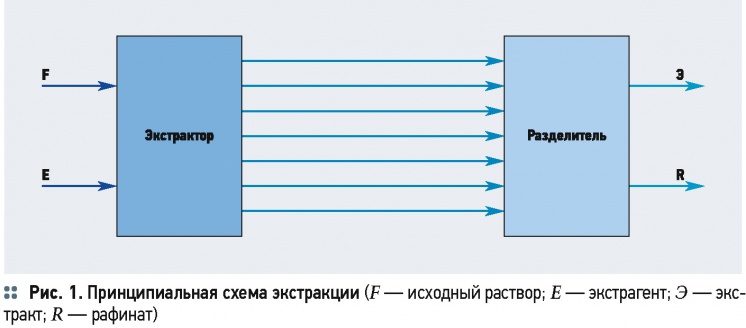
Принципиальная схема экстракции приведена на рис. 1. В экстрактор загружаются исходный раствор F, содержащий распределяемое (экстрагируемое) вещество или вещества М, растворитель L и экстрагент E. Массообмен между фазами протекает при их непосредственном контакте. Полученная в результате экстракции жидкая смесь поступает в разделитель, где разделяется на экстракт Э (раствор экстрагированных веществ в экстрагенте) и рафинат R (остаточный раствор, из которого экстрагированы извлекаемые компоненты).
Разделение смеси на экстракт и рафинат происходит в результате отстаивания или сепарирования.
Процесс экстракции включает три последовательные стадии:
- смешение исходной смеси веществ с экстрагентом (диспергирование фаз);
- механическое разделение (расслаивание) двух образующихся фаз на экстракт (извлекающая фаза) и рафинат (исчерпываемая фаза);
- удаление экстрагента из обеих фаз и его регенерацию с целью повторного использования, для чего наряду с дистилляцией часто применяют реэкстракцию (процесс, обратный жидкостной экстракции), обрабатывая экстракт водными растворами веществ, обеспечивающих полный перевод целевых компонентов в раствор или осадок и их концентрирование.
Выделение экстрагированного вещества из экстракта и одновременная регенерация экстрагента производится таким процессом как дистилляция.
Процесс экстракции проводится в аппаратах различной конструкции — экстракторах. Во многих случаях экстракцию применяют в сочетании с ректификацией. Поскольку расход теплоты на ректификацию уменьшается с увеличением концентрации исходного раствора, предварительное концентрирование раствора экстракцией позволяет сократить расход теплоты на разделение исходной смеси. В результате однократной экстракции возможна сравнительно небольшая степень извлечения вещества из исходного раствора, поэтому прибегают к многократному повторению актов смешения и последующего расслаивания взаимодействующих фаз при их встречном движении.
При выборе растворителя (экстрагента) учитывают его избирательность и растворяющую способность, которые различны для каждого растворителя и зависят как от технологических условий процесса, так и от химического состава сырья [2]. Чем больше избирательность растворителя, тем более эффективно разделяются компоненты при контакте с ним, большей избирательности соответствует больший коэффициент распределения К. Чем выше растворяющая способность растворителя, тем большую массу извлекаемых компонентов можно растворить в нём, и тем меньше потребуется расход растворителя.
Избирательность и растворяющая способность растворителя «антибатны», как правило, то есть рост одного показателя ведёт к снижению другого [3]. При повышении температуры избирательность растворителя уменьшается, а его растворяющая способность возрастает, и наоборот. Обычно с повышением температуры растворимость в обеих фазах возрастает, а при достижении определённой температуры образуется однородный раствор — эта температура называется критической температурой растворения (КТР). В этом случае процесс экстракции не может быть осуществлён, так как нельзя разделить экстрактный и рафинатный растворы [4]. Поэтому рабочая температура процесса должна быть ниже КТР. Поскольку процесс экстракции происходит при условии, что смесь растворителя и разделяемого вещества образует гетерогенную систему, необходимо выбирать такую температуру процесса, которая обеспечивает достаточно высокую избирательность и растворяющую способность растворителя.
Для создания внутренней циркуляции потоков в экстракторах и повышения эффективности экстракции поддерживается температурный градиент экстракции, то есть температура рафинатной зоны (верх экстракционной колонны) должна быть выше температуры экстрактной зоны (низ экстракционной колонны). Температурный градиент, который в большинстве случаев составляет от 5 до 30 °C, создаётся путём подачи в экстрактор раствора и растворителя с разными температурами, а также рециркуляцией части охлаждённого экстрактного раствора.
Процесс жидкостной экстракции предполагает перенос одного или более растворимых веществ, содержащихся в растворе, в другую несмешиваемую жидкую фазу (экстрагент). Экстрагент, обогащённый растворимыми веществами, называется экстрактом
В процессе жидкостной экстракции могут быть выделены три основных составляющих (условных компонента): избирательный растворитель, извлекаемые компоненты и неизвлекаемые компоненты. Поэтому для расчёта процесса экстракции используются трёхкомпонентные треугольные диаграммы. После отделения растворителя от экстрактного раствора получают экстракт, а от рафинатного раствора — рафинат.
Регенерация экстракта, заключающаяся в отделении экстрагента от загрязняющего вещества, проводится отгонкой под атмосферным давлением или под вакуумом, либо ректификацией. Операция облегчается, если экстрагент имеет низкую температуру кипения.
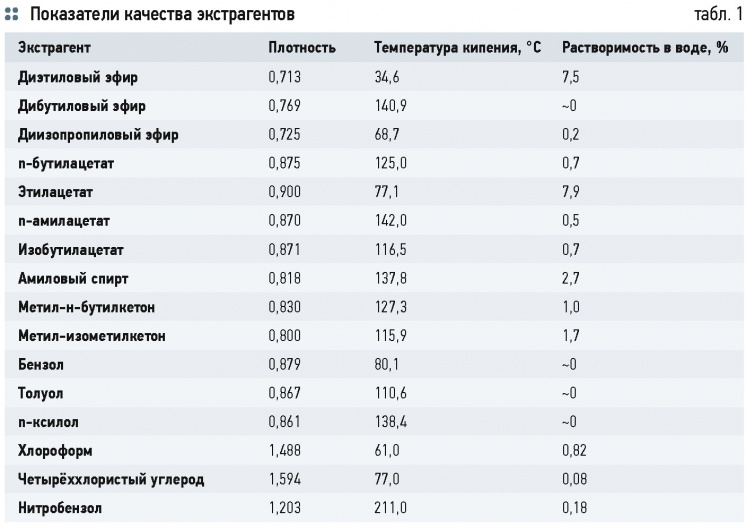
В промышленных условиях для экстракции используются такие органические растворители, как фенол, фурфурол,
N-метилпироллидон, бензол, диэтиленгликоль, пропан и др. Показатели некоторых экстрагентов приведены в табл. 1.
Экстрагенты должны отвечать ряду дополнительных требований: обладать высокой селективностью и растворяющей способностью; большей разностью плотностей в зоне вывода экстрактного раствора (+0,2) и большей разностью температур кипения для экстрагента и извлекаемого компонента (+50 °C); большей химической стойкостью и большим значением коэффициента поверхностного натяжения, чтобы избежать образования стойкой эмульсии; малой теплотой испарения; не вступать в химическое взаимодействие с удаляемыми веществами; быть безопасными; не образовывать токсичные, взрывоопасные или огнеопасные смеси с воздухом; иметь малую растворимость в воде.
Равновесие в системе «жидкость-жидкость»
Переход распределяемого вещества из одной жидкой фазы (исходного раствора) в другую (экстрагент) происходит до установления равновесия, то есть до выравнивания химических потенциалов в фазах. В процессе участвуют три компонента (К = 3) и две фазы (Ф = 2). Согласно правилу фаз вариантность системы F = 3. Однако температура и давление при проведении процесса экстракции поддерживаются постоянными. Тогда вариантность экстракционной системы будет равняться единице. Поэтому данной концентрации распределяемого вещества в одной фазе в состоянии равновесия соответствует определённая концентрация в другой.
Равновесие в процессах экстракции характеризует коэффициент распределения ф, который равен отношению равновесных концентраций экстрагируемого вещества в обеих жидких фазах — в экстракте и рафинате. В простейших системах разбавленных растворов, подчиняющихся закону Бертло-Нернста, при постоянной температуре коэффициент распределения не зависит от концентрации распределяемого вещества:
φ = yp / х, (1)
где yp и х — равновесные концентрации распределяемого вещества в экстракте и рафинате. В этом случае линия равновесия — прямая:
yp = φх. (2)
Уравнению (2) отвечают начальные участки изотерм экстракции. При наличии диссоциации и ассоциации молекул растворённого вещества и его химического взаимодействия с экстрактом коэффициент распределения изменяется с концентрацией, и изотермы экстракции отклоняются от прямой. В области высоких концентраций такие отклонения вызваны изменением коэффициентов активности в фазах. Коэффициент распределения определяется экспериментальным путём.
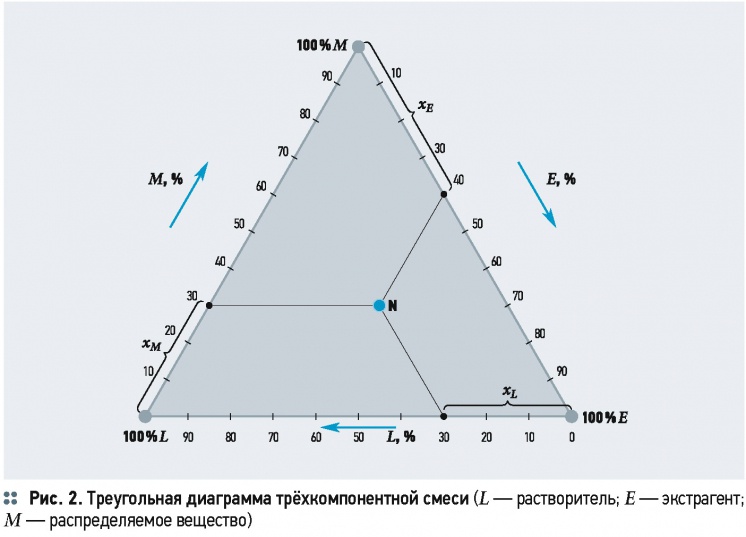
Если считать обе жидкие фазы нерастворимыми друг в друге, то каждая из фаз будет представлять собой двухкомпонентный раствор. В этом случае процесс экстракции по аналогии с другими массообменными процессами (дистилляция, ректификация [5]) может быть изображён в у-х-координатах. При частичной взаимной растворимости жидких фаз каждая из них при экстракции будет представлять собой трёхкомпонентный раствор. Составы трёхкомпонентных смесей представляют в треугольной системе координат (рис. 2).
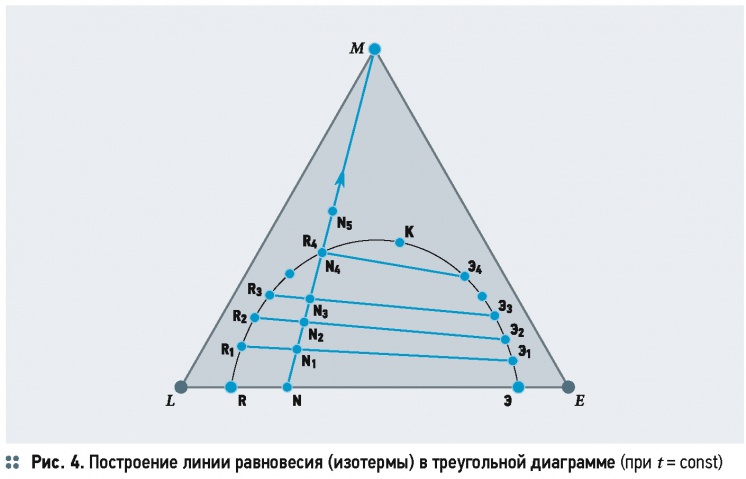
В вершинах равностороннего треугольника L, M и E отложены составы (100 %) компонентов: растворителя — L, экстрагента — E и распределяемого вещества — M. Каждая точка на сторонах LM, ME и EL соответствует составу двухкомпонентных растворов. Площадь, заключённая внутри треугольника, соответствует составам трёхкомпонентных растворов (тройным смесям). Для определения содержания каждого компонента в растворе на сторонах диаграммы нанесены шкалы отсчёта. Длина каждой стороны принята за 100 % (массовых, объёмных или мольных). Состав раствора или смеси определяется длиной отрезков, проведённых параллельно каждой стороне треугольника до пересечения с двумя другими. Например, точка N характеризует тройную смесь, состоящую из 30 % растворителя L, 41 % экстрагента Е и 30 % распределяемого вещества М.
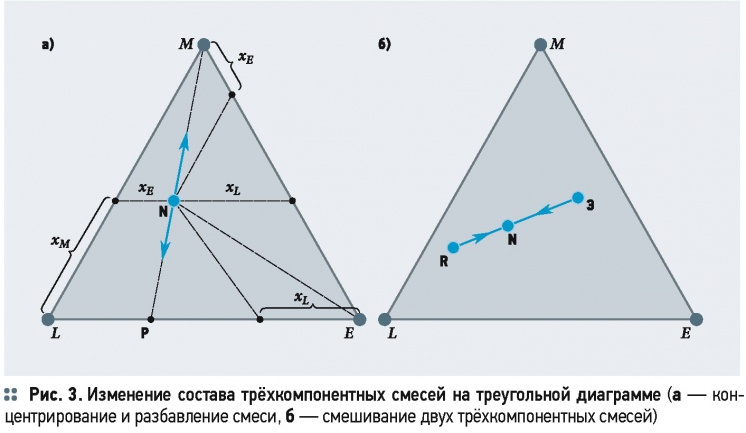
Из этой диаграммы определяются и процессы изменения состава трёхкомпонентных смесей. Так, при прибавлении к раствору, характеризуемому точкой N (рис. 3а), распределяемого вещества М
содержание компонентов Е и L не изменяется, а точки, определяющие составы полученных растворов, будут находиться на прямой NM, приближаясь к вершине треугольника М, в зависимости от количества прибавленного компонента М. При извлечении распределяемого вещества М из смеси N точки, соответствующие получаемым составам, будут лежать на прямой РМ, и чем более будет разбавлен раствор, тем ближе к стороне треугольника LE. Линия NE характеризует разбавление смеси состава N экстрагентом Е. С помощью треугольной диаграммы по известному количеству и составу исходной смеси (точка N) и составам, получаемым при её разделении на экстракт (точка Э) и рафинат (точка R), определяется количество этих фаз (рис. 3б) по уравнению материального баланса:
R + Э = N, (3)
где R, Э и N — масса рафината, экстракта и исходной смеси, соответственно, кг. По «правилу рычага» имеем:

Примем условие, что распределяемое вещество М неограниченно растворяется в обеих жидких фазах L и Е, а сами растворители имеют ограниченную растворимость друг в друге (рис. 3). Составы однородных двухкомпонентных растворов (М и L, М и Е) характеризуются точками на сторонах диаграммы LM и ЕМ. Растворители L и Е образуют однородные растворы только на небольших участках LR и ЭЕ. Смесь растворителей на участке RЭ расслаивается на два однородных двухкомпонентных насыщенных раствора R (насыщенный раствор Е в L) и Э (насыщенный раствор L в Е). Причём количество насыщенных растворов в каждом из двух слоёв определяется положением точки N и находится по правилу рычага, см. уравнение (4).
При добавлении вещества М в смесь состава N образуется тройная смесь состава, характеризуемого точкой N1, лежащей на прямой NM. Смесь состава N1 расслаивается на две фазы с равновесными составами Ri и Э1 в соотношении Э1N1/R1N1. При дальнейшем добавлении в смесь распределяемого вещества M2, M3, ... получим тройные смеси составов N2, N3, ..., которые также расслаиваются на фазы с равновесными составами R2 и Э2, R3 и Э3 и т.д. При этом изменяются и массовые соотношения равновесных расходов до того момента, когда одна из фаз исчезнет при составе N4. После этого при добавлении распределяемого вещества М образуются однородные тройные растворы состава N5 и др. Если соединить R1 и Э1, R2 и Э2, ... прямыми линиями, получаются хорды равновесия R1Э1, R2Э2, ..., соответствующие равновесным составам. Хорды равновесия сходятся в точке К, называемой критической. Наклон хорды равновесия определяется природой компонентов и составом фаз. Соединив точки, характеризующие равновесные составы R, R1, R2 и Э, Э1, Э2, ... плавной кривой, получим кривую равновесия (бинодальную кривую). Ветвь RK кривой равновесия характеризует равновесные составы фазы растворителя L, а ветвь ЭК — равновесные составы фазы растворителя Е. Бинодальная кривая на треугольной диаграмме разграничивает области, соответствующие двухфазным смесям (под бинодальной кривой) и однофазным растворам (вне бинодальной кривой). Приведённая на рис. 4 диаграмма равновесия составлена для постоянной температуры и называется изотермой экстракцией. На практике приходится иметь дело с компонентами, обладающими частичной растворимостью в определённых интервалах концентраций. Соответственно поведению компонентов треугольные диаграммы бывают с двумя и тремя зонами ограниченной растворимости.
При выборе растворителя учитывают его избирательность и растворяющую способность, различные для каждого растворителя и зависящие от технологических условий процесса и от химического состава сырья
На равновесие системы оказывает влияние также температура. Взаимная растворимость компонентов, как правило, с повышением температуры увеличивается, следовательно, область существования гетерогенных систем уменьшается.
С увеличением температуры бинодальная кривая на рис. 4 будет приближаться к оси LE, при этом площадь под линией RKЭ будет уменьшаться.
Массопередача при жидкостной экстракции
Кинетические закономерности процесса экстракции определяются основными законами массопередачи. Для увеличения площади поверхности фазового контакта одну из фаз диспергируют в виде капель в другой сплошной фазе. Площадь поверхности фазового контакта определяется задержкой дисперсной фазы в экстракторе и средним поверхностно-объёмным диаметром капель. Распределяемое вещество диффундирует из сплошной фазы к поверхности капель, а затем внутрь капли, либо, наоборот, из капли через поверхность раздела фаз в сплошную фазу.
Массопередача внутри капель осуществляется молекулярной и конвективной диффузией [6]. Конвекция внутри капель возникает за счёт циркуляции жидкости. Форма и размер капель в процессе экстракции многократно меняются за счёт диспергирования и коалесценции. При этом происходит обновление поверхности межфазного контакта.
Для описания массопередачи в твёрдой фазе в процессах экстракции пользуются первым и вторым законами Фика [7], определяющими, что скорость диффузии прямо пропорциональна коэффициенту диффузии поверхности (через которую протекает процесс диффузии) и разности концентраций диффундирующего вещества на границах со слоем растворителя, и обратно пропорциональна толщине слоя.
В общем случае, когда диффузионным сопротивлением в сплошной и дисперсной фазах пренебречь нельзя, коэффициент массопередачи определяется как:
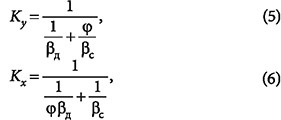
где βд и βс — коэффициенты массоотдачи в дисперсной и сплошной фазах; φ — коэффициент формы, равный для пластины 1, для цилиндра — 2, для шара — 3. В случае, если диффузионное сопротивление сосредоточено в сплошной фазе, из уравнений (5) и (6) получим K = βд, и скорость процесса определяется внешнедиффузионными факторами.
Количество вещества, перемещающегося из дисперсной фазы к поверхности на границе раздела фаз, и количество распределяемого вещества, перемещающегося от элемента поверхности в сплошную фазу, определяются по уравнениям:
dMy = βд(yр – yд), (7)
dMx = βс(xр – xс). (8)
В случае, если основное диффузионное сопротивление сосредоточено в дисперсной фазе, то есть внутри капель, количество вещества, перешедшего из одной фазы в другую, можно определить из основного уравнения массопередачи:
M = βдDyсрF, (9)
где Dyср — движущая сила процесса; F — площадь поверхности массопередачи.
Коэффициенты массоотдачи в фазах рассчитывают по критериальным уравнениям, которые получают на основании экспериментальных данных. Среднюю движущую силу экстракции рассчитывают с учётом фактора масштабного перехода с введением в расчётные уравнения его значения.
Технологические схемы и расчёт процессов жидкостной экстракции
В промышленности используют периодическую или непрерывную экстракцию по следующим схемам: одноступенчатой, многоступенчатой противоточной и многоступенчатой с перекрёстным током экстрагента [8].
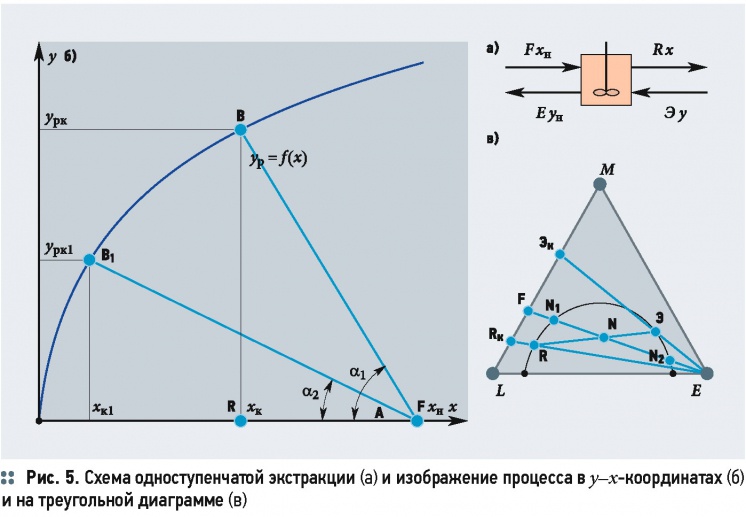
Одноступенчатая экстракция применяется в тех случаях, когда коэффициент разделения имеет высокие значения. Она может осуществляться периодическим и непрерывным способами по схеме, приведённой на рис. 5а. В аппарат-смеситель загружают исходный раствор F в количестве L [кг] растворителя концентрацией хн и экстрагент Е, которые перемешиваются мешалкой, а затем разделяются на два слоя: экстракт Э и рафинат R. Для разделения эмульсий используются отстойники, для трудноразделимых эмульсий — сепараторы.
Материальный баланс по распределяемому веществу определяется следующим уравнением:
Lxн = Lx + Ly. (10)
Полагая, что у = φх и модуль экстракции m = E/L, получим концентрации рафината в следующем виде:

и экстракта:

при этом степень извлечения:
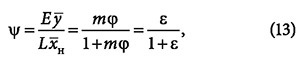
где ε — экстракционный фактор, который выражается как ε = φ(A/L). Одноступенчатая экстракция в диаграммах показана на рис. 5б-в. При перемешивании исходного раствора с экстрагентом образуется тройная смесь, состав которой характеризует точка N на линии смешения FE. После расслаивания смеси образуются экстракт и рафинат, составы которых определяются точками R и Э на хорде равновесия, проходящей через точку N.
Продолжение следует.