
В подземных водах, используемых для хозяйственно-питьевого водоснабжения, наряду с повышенным содержанием железа может наблюдаться повышенное содержание марганца, предельно допустимая концентрация (ПДК) которого согласно [1] должна составлять не более 0,1 мг/л. При этом задача удаления избыточного марганца является более сложной, чем удаление избыточного железа.
Из курса неорганической химии известно, что марганец (помимо, конечно, металлического марганца) имеет наиболее характерные степени окисления (+2), (+3), (+4) и (+7). Так как большинство соединений двухвалентного марганца хорошо растворимы в воде, то именно катион Mn2+ обычно и является той формой, которая содержится в подземных водах и подлежит удалению в случае превышения нормативных значений. Из соединений марганца со степенью окисления (+2) и (+3) (помимо прочих) наибольшее значение имеют оксиды марганца Mn2O3 и MnO2, гидроксид марганца Mn(OH)2, которые весьма малорастворимы в воде. Степень окисления (+7) обычно ассоциируется с перманганатом калия KMnO4, который в качестве реагента нашёл широкое применение, в том числе и в водоподготовке.
Формы марганца, соответственно, определяют способы снижения его концентрации в воде, каковыми являются:
- увеличение окислительно-восстановительного потенциала (ОВП, Eh) путём введения в воду сильных окислителей;
- повышение рН воды при недостаточном ОВП (Eh) в случае использования слабых окислителей;
- совместное использование сильных окислителей с одновременным повышением рН воды.
В первом и последнем случаях пытаются добиться перевода марганца, находящегося в ионной форме, в малорастворимые Mn2O3 и MnO2, во втором случае — в малорастворимый гидроксид Mn(OH)2.

На практике указанные способы воплощаются в виде следующих технологических решений:
- удаление марганца методом глубокой аэрации с последующим фильтрованием;
- деманганация сильными окислителями (хлором, диоксидом хлора, озоном);
- удаление марганца с использованием перманганата калия;
- деманганация фильтрованием через модифицированную загрузку;
- удаление марганца методом ионного обмена;
- биохимический способ деманганации.
В качестве наглядного пособия в литературе по водоподготовке часто приводят диаграмму Пурбе для марганца, показывающую термодинамически устойчивые формы существования химического элемента (в данном случае марганца) в водных растворах при различных значениях рН и окислительно-восстановительного потенциала (рис. 1).
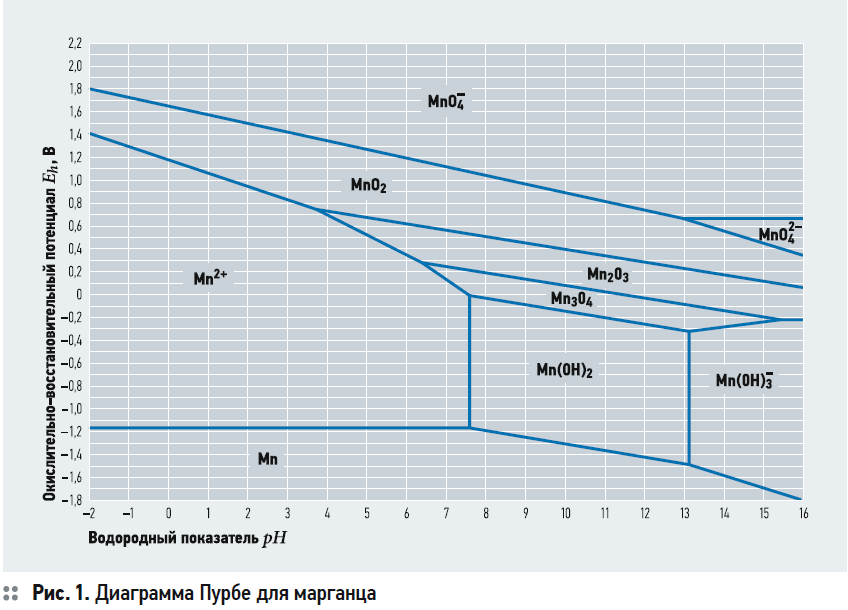
Из перечисленных выше методов биохимический метод не нашёл сколько-нибудь широкого применения и скорее может рассматриваться как некая экзотика. Ионный обмен для удаления марганца чаще всего используют в малых системах водоснабжения, рассчитанных на несколько потребителей или даже на один дом или квартиру, и почти всегда при необходимости одновременного умягчения воды. Ионообменная смола в этом случае загружается в корпус напорного фильтра с управляющим клапаном, что позволяет создавать компактные и удобные в обслуживании установки.
Примечательно, что среди технологических решений не упоминается повышение рН ради образования малорастворимого Mn(OH)2, что можно объяснить с помощью несложных химических расчётов. Известно, что константа гидролиза малорастворимого основания Кг, которая, по сути, является константой равновесия гидролитической реакции, определяется следующим образом:
Kг = Кв/Кд, (1)
где Кв — ионное произведение воды, Кв = 10–14; Кд — константа диссоциации основания.
Степень гидролиза, определяющая отношение количества гидролизованного катиона к общему его количеству:
hг = Kг/[H+]. (2)
Гидролиз двухвалентного марганца происходит в две стадии с константами диссоциации Кд1 = 9,1×10–4 и Кд2 = 5,0×10–4, соответственно. Расчёты показывают, что добиться степени гидролиза «1″, то есть когда весь двухвалентный марганец гидролизируется, можно при рН не менее 11, что нецелесообразно с практической точки зрения и не соответствует требованиям [1] по значению рН.
Таким образом, все основные промышленные способы деманганации воды являются окислительными, различается только тип реагента и аппаратное оформление технологии. Соответственно, и уравнения реакции должны быть окислительно-восстановительными, которые учитывают изменение степени окисления у атомов реагирующих веществ. Окислителями в таком случае могут быть кислород воздуха (или технический кислород), соединения хлора, перманганат калия, озон. Каждый из этих окислителей полезно рассмотреть отдельно с точки зрения химии процесса.
Стоит отметить, что описанные в литературе методы, такие как глубокая аэрация с последующим фильтрованием, каталитическое окисление марганца, фильтрование через модифицированную загрузку, в любом предполагают использование кислорода в качестве окислителя. Данный вывод следует из характера самих окислительно-восстановительных реакций, которые предполагают, что окислитель принимает такое же количество электронов, которое отдаёт восстановитель. Уравнения химических реакций в этом случае обычно записывают в следующем виде:
Mn(OH)4 + Mn(OH)2 → Mn2O3 + 3H2O, (3)
2Mn2O3 + 2O2 + 8H2O → Mn(OH)4↓. (4)
К ним даётся следующее пояснение: предварительно осаждённые на поверхности зёрен загрузки оксиды марганца оказывают каталитическое влияние на процесс окисления марганца растворённым в воде кислородом; при фильтровании аэрированной и подщелаченной воды на песчаной загрузке образуется слой, состоящий из отрицательно заряженного гидроксида марганца Mn(OH)4, который адсорбирует положительно заряженные катионы Mn2+; гидролизируясь, эти ионы реагируют с осадком Mn(OH)4, образуя полутораоксид Mn2O3; таким образом, в результате снова образуется гидроксид марганца (+4), который опять участвует в процессе окисления в качестве катализатора.
Уравнения (3) и (4), однако, вызывают определённые вопросы.
Во-первых, на диаграмме Пурбе нет такого соединения, как гидроксид марганца Mn(OH)4. Из литературных источников следует, что Mn(OH)4 является неустойчивым соединением, проявляющим амфотерные свойства (способность проявлять свойства как кислоты, так и основания), которое при комнатной температуре разлагается до MnO2·nH2O и иных форм гидроксида марганца. Каким образом Mn(OH)4 может образовывать слой осадка, не вполне понятно.
Во-вторых, если в уравнении (4) марганец окисляется от степени окисления (+3) до (+4), то этому уравнению должна соответствовать определённая полуреакция окисления. Однако автору неизвестно ни одной такой полуреакции, где происходило бы превращение трёхвалентного марганца в четырёхвалентный с образованием Mn(OH)4.
Ни в одном из уравнений (3) и (4) не показан механизм окисления растворённого двухвалентного катиона марганца до трёхи четырёхвалентного, что, собственно, и является сутью процесса окислительной деманганации.
Оба оксида марганца Mn2O3 и MnO2 малорастворимы в воде, поэтому не вполне понятно, в какой форме марганец накапливается в осадке — данных об этом недостаточно (считается, что MnO2 — более устойчивое соединение).

Установка AdEdge в городе Розуэлле, штат Джорджия (США), обеспечивает очистку сточных вод на уровне менее 0,3 мг/л по железу и менее 0,05 мг/л по марганцу
Приведём две основных (на взгляд автора) полуреакции окисления Mn2+ до малорастворимых форм:
Mn2O3 + 6H+ + 2e → Mn2+ + 2H2O, (5)
здесь стандартный электродный потенциал полуреакции составляет Е0 = +1,443 В;
MnO2 + 8H+ + 2e → Mn2+ + 2H2O, (6)
здесь стандартный электродный потенциал полуреакции равен Е0 = +1,507 В.
В полуреакциях (5) и (6) двухвалентный марганец окисляется до степени окисления (+3) или (+4), то есть является восстановителем. Если предполагать, что окисление происходит за счёт кислорода, то полуреакция окисления должна быть дополнена полуреакцией восстановления с участием O2. Однако из известных подобных полуреакций наиболее высоким стандартным электродным потенциалом обладает полуреакция:
O2 + 4H+ + 4e → 2H2O, (7)
здесь стандартный электродный потенциал полуреакции равен Е0 = +1,228 В; окислителем является кислород.
Условием протекания окислительно-восстановительной реакции является превышение Е0 окислителя над Е0 восстановителя, что в данном случае не соблюдается. Следовательно, реакция окисления двухвалентного марганца кислородом с точки зрения термодинамики самопроизвольно протекать не может.
Вероятно, поэтому удаление марганца из воды является столь непростой задачей и достигается далеко не всегда безреагентными методами (применение кислорода воздуха в качестве окислителя считается безреагентным методом).
Известно, что для эффективного окисления двухвалентного марганца кислородом рекомендуется подщелачивание воды, а также требуется соблюдение соотношения Fe2+/Mn2+ = 7–10, что никак не отражается в уравнениях (3) и (4). Это дополнительный довод в пользу того, что механизм деманганации более сложен, чем согласно (3) и (4). Упоминание о каталитическом действии соединений марганца, железа, меди (используемых в виде реагентов или выделившихся при водоподготовке) не может убедительно объяснить протекание процесса деманганации окислением с помощью кислорода, так как катализаторы, ускоряя ход химической реакции, тем не менее не позволяют осуществляться термодинамически невозможным реакциям. В данном случае отмечается превышение стандартного электродного потенциала полуреакции окисления (Mn2+ → Mn3+, Mn2+ → Mn4+) над стандартным электродным потенциалом полуреакции восстановления (O0 → O2-). Следовательно уравнения реакции окисления двухвалентного марганца с образованием малорастворимых веществ должны иметь иной вид, чем это следует из выражений (3) и (4).
Механизм окисления двухвалентного марганца различными химическими реагентами (соединениями хлора, озоном, перманганатом калия) должен быть также представлен в виде соответствующих химических реакций, где восстановителем будет двухвалентный марганец, а окислителем — тот или иной химический реагент, о чём следует рассказать в отдельной публикации.

Выводы
Безреагентное удаление марганца из воды часто имеет невысокую эффективность и нестабильно. В данной статье отмечено, что описание явления с помощью химических уравнений (3) и (4) (обычно в этом случае говорят о безреагентной технологии деманганации) является не вполне корректным с точки зрения химии. Дальнейшие исследования должны дать более полные и достоверные сведения относительно механизма окисления двухвалентного марганца без использования химических реагентов, что позволит обеспечить необходимые условия для более полного удаления марганца из воды. Кроме того, необходимы исследования состава осадка станций деманганации воды (чаще всего они являются и станциями обезжелезивания воды) для получения более точных сведений о формах марганца после его окисления при водоподготовке.

























